
| A�� | 0.40mol | B�� | ��0.20mol | ||
| C�� | ����0.20mol | D�� | ��0.40mol������0.20mol |
���� ƽ��ʱ����1.0mol PCl3��0.50mol Cl2����ƽ�ⲻ�ƶ���PCl5Ϊ0.20mol���������ʱѹǿ��С��ƽ��ƽ���ƶ����Դ������
��� �⣺ƽ��ʱ����1.0mol PCl3��0.50mol Cl2����ƽ�ⲻ�ƶ���PCl5Ϊ0.20mol���������ʱѹǿ��С��ƽ��ƽ���ƶ�����ﵽ��ƽ��ʱPCl5�����ʵ���С��0.2mol��
��ѡB��
���� ���⿼�黯ѧƽ����ƶ���Ϊ��Ƶ���㣬�������ʵ�����ѹǿ�Ĺ�ϵ��ѹǿ��ƽ���ƶ���Ӱ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�̬�뾲̬�Ľ�ϣ���Ŀ�ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
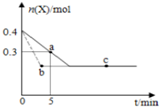 �ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������
�ں���2L�ܱ�������ͨ������X��������Ӧ��2X��g���TY��g����H��0��X�����ʵ���n��x����ʱ��t�仯��������ͼ��ʾ��ͼ�е������߷ֱ���������������Σ�������������ȷ���ǣ�������| A�� | ʵ�߱�ʾʹ�ô��������� | |
| B�� | b��c���������Ӧ����Ӧ�����´ﵽ������� | |
| C�� | ��Ӧ�ӿ�ʼ��a���ƽ����Ӧ���ʿɱ�ʾΪv��Y��=0.01mol/��L•min�� | |
| D�� | ��Ӧ���е�a��ʱ�ų����������ڷ�Ӧ���е�b��ʱ�ų������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
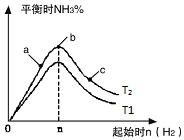 �ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ������У���Ϊ������������Ϊ��ѹ�������������з�Ӧ��N2��g��+3H2��g��?2NH3��g����H2=-92.4kJ/mol���й����ݼ��ض�ƽ��״̬������
�ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ������У���Ϊ������������Ϊ��ѹ�������������з�Ӧ��N2��g��+3H2��g��?2NH3��g����H2=-92.4kJ/mol���й����ݼ��ض�ƽ��״̬������| ���� | ��ʼͶ�� | ��ƽ��ʱ | |||
| �� | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| �� | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
| ѡ�� | a | b | c | d |
| x | �¶� | �¶� | ����H2�����ʵ��� | ���백�������ʵ��� |
| y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ������ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������ڴ�л�����ղ��������� | |
| B�� | ���յ�����û���������� | |
| C�� | ��ʳ�ؽ����λ�ʹ���ж���Ӧ������ţ�̡������ⶾ | |
| D�� | ���Ȼ�ʹ�����ʱ��ԣ�������Լ�������Ժ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��g������H=-1367.0 kJ/mol��ȼ���ȣ� | |
| B�� | NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l������H=-57.3kJ/mol���к��ȣ� | |
| C�� | S��s��+O2��g���TSO2��g������H=+269.8kJ/mol����Ӧ�ȣ� | |
| D�� | 2HCl��g���TCl2��g��+H2��g������H=-184.6kJ/mol����Ӧ�ȣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ε�����в�һ�����н���Ԫ�� | |
| B�� | ǿ�������Һ�ĵ���������һ�������������Һ�ĵ�������ǿ | |
| C�� | ͬ��Ԫ���ڲ�ͬ�Ļ������еĻ��ϼ۲�һ����ͬ | |
| D�� | ��ͬ��Ԫ����ɵ�����һ���ǵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 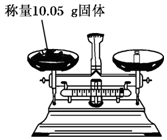 | B�� | 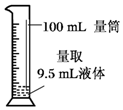 | ||
| C�� | 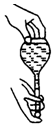 �������ƿ�Ƿ�©ˮ | D�� | 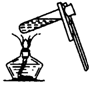 ��Һ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al3++4OH-��[Al��OH��4]- | B�� | Al2O3+2OH-+3H2O=2[Al��OH��4]- | ||
| C�� | CO2+2OH-=CO32-+H2O | D�� | 2Al+2OH-+6H2O=2[Al��OH��4]-+3H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com