
| A. | 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定 | |
| B. | Cu的湿法冶炼是将金属钠投入到CuSO4溶液中置换出铜 | |
| C. | 炼铁时加入石灰石的目的是除去过量的碳 | |
| D. | 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al |
分析 A、金属冶炼是工业上将金属从含有金属元素的矿石中还原出来.金属的活动性不同,可以采用不同的冶炼方法.
B、湿法炼铜:Fe+CuSO4=Cu+FeSO4,利用铁的活动性比铜强;
C.加入石灰石的目的是造渣,就是和铁矿石里的二氧化硅形成硅酸钙炉渣;
D、AlCl3是共价化合物,熔融状态下不导电.
解答 解:A、金属冶炼的本质是将化合态金属还原为游离态,活泼金属采用电解法冶炼,不活泼的金属采用直接加热法冶炼,大部分金属的冶炼都是在高温下采用氧化还原反应法,故A正确;
B、Cu的湿法冶炼是将金属铁投入到CuSO4溶液中,从而置换出铜,不能用钠,钠能与水反应,故B错误;
C、Fe通常采用热还原法冶炼,加入石灰石的目的是和铁矿石里的二氧化硅形成硅酸钙炉渣,故C错误;
D、由于Al的活泼性强,工业上采用电解Al2O3与冰晶石熔融混合物的方法生产铝,AlCl3是共价化合物,熔融状态下不导电,所以不用电解AlCl3的方法生产铝,故D错误;
故选A.
点评 本题考查了金属的冶炼的一般原理,难度不大,金属的活泼性不同,冶炼方法不同,活泼金属采用电解法冶炼,不活泼的金属采用直接加热法冶炼,大部分金属的冶炼都是在高温下采用氧化还原反应法.


科目:高中化学 来源: 题型:选择题
| A. | Cu2+、H+、Cl- | B. | Cl-、CO32-、OH- | C. | K+、H+、Cl- | D. | K+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜器出现铜绿 | B. | 铁制菜刀生锈 | ||
| C. | 大理石雕像被酸雨腐蚀毁坏 | D. | 铝锅表面生成致密的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
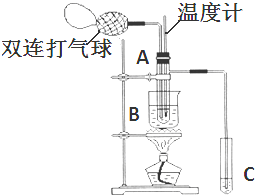
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-N | N═N |
| 键能/kJ•mol | 436 | 391 | 946 |
| A. | +1472kJ•mol-1 | B. | -1472kJ•mol-1 | C. | +92kJ•mol-1 | D. | -92kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 具体物质 | 物质类别 | 具体物质 |
| 压缩气体和液化气体 | 氩气、压缩天然气易燃固体、自然物品和遇湿易燃物品 | 硫磺、硝化纤维素、电石、硅钙合金、钠、钾 | |
| 氧化剂和有机过氧化物 | 硝酸钾、硝酸钠、过氧乙酸 | 易燃液体 | 甲乙酮、乙酸乙酯 |
| 腐蚀品、杂类 | 甲酸、磷酸、甲基磺酸、烧碱、硫化碱 | 毒害品 | 氰化钠、甲苯二异氰酸酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀 | |
| B. | 操作②、操作③分别是过滤与蒸发结晶 | |
| C. | 反应①加料之前需将反应器加热至100℃以上并通入氩气 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
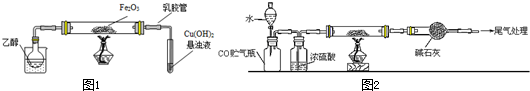
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com