
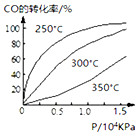
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式;
(2)根据盖斯定律来分析计算:一个反应无论是一步完成还是分为几步完成,其热效应是相同的;根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO,
故答案为:3NO2+H2O═2HNO3+NO;
(2)已知:①2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,
②2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.
根据盖斯定律可知:将$\frac{①}{2}-\frac{②}{2}$可得:NO2(g)+SO2(g)═SO3(g)+NO(g)△H=($\frac{-196.6}{2}-\frac{-113.0}{2}$)kJ•mol-1=-41.8 kJ•mol-1;
A、反应前后气体两边的计量数相等,所以体系压强始终不变,故A错误;
B、混合气体颜色保持不变,则二氧化氮的浓度不变,正逆反应速率相等,说明达平衡状态,故B正确;
C、三氧化硫和一氧化氮的体积比始终是1:1,无法判断是否达到了平衡状态,故C错误;
D、表示的都是逆反应速率,无法判断正逆反应速率相等,无法判断各组分浓度是否不变,故D错误;
故选:B.
故答案为:-41.8;B;
(3)从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动,即逆反应吸热,则正反应放热,即△H<0;实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大,
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
点评 本题考查了化学方程式的书写,盖斯定律的应用,化学平衡状态的判断,题目难度不大,属于基础型题目.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的金属性依次减弱 | B. | H2S、H2O、HF的稳定性依次减弱 | ||
| C. | Cl-、Br-、I- 还原性依次增强 | D. | Na、K、Rb的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径X>Y>Z | |
| B. | 离子半径Ym->Xn+>Zm+ | |
| C. | 三种元素最高价氧化物对应水化物碱性依次减弱,酸性依次增强的顺序是X,Z,Y | |
| D. | Y在自然界中没有游离态,可形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 滴定到终点读数时,发现滴定管尖嘴内有气泡 | |
| D. | 配制标准溶液的NaOH中混有KOH杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1NaClO溶液中:Fe2+、K+、I-、Cl- | |
| B. | 加入铝片能放出H2的溶液中:K+、Ba2+、Cl-、NH4+ | |
| C. | 由水电离出的c(OH-)=1×10-12mol•L-1溶液中:NH4+、HCO3-、Na+、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14的溶液中:K+、Na+、I-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(HCO3)2、Al(NO3)3 | B. | CaCl2、NaHCO3 | C. | Al2(SO4)3、NaOH | D. | Na2CO3、CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com