
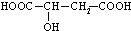 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸能使紫色的石蕊试液变红 | |
| B. | 苹果酸能发生酯化反应 | |
| C. |  与苹果酸是同一种物质 与苹果酸是同一种物质 | |
| D. | 1mol苹果酸在一定条件下可与2molH2发生加成反应 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )
一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )| A. | 铁为阳极,电极反应式为2H2O+2e-=H2↑+2OH- | |
| B. | 若阴极产生3.36L(标况)气体,则溶液中的反应转移电子0.30mol | |
| C. | 电解槽内总反应方程式为:NaCl+3H2O $\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑ | |
| D. | 用阳离子交换膜代替阴离子交换膜,也一样可以制得NaClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
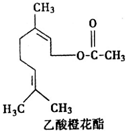
| A. | 分子式为C12H20O2 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 能发生加成反应,但不能发生取代反应 | |
| D. | 1mol该有机物水解时只能消耗lmolNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2LN2和NO的混合气体所含的原子数为NA | |
| B. | 1mol C8H18分子中,共价键总数为25NA | |
| C. | 标准状况下,22.4L盐酸含有nA个HCl分子 | |
| D. | 含0.1molH2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2、NH3的水溶液虽都能够导电,但它们均属于非电解质 | |
| B. | 在浓硝酸中加入等体积浓硫酸后,立即加入铝片,铝片发生钝化 | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 | |
| D. | 电解饱和食盐水的过程中,水的电离平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
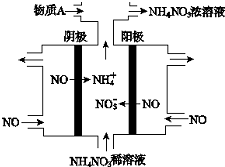
| A. | 阳极上的电极反应为:NO•3e-+4OH-=NO3-+2H2O | |
| B. | 电解生成1 mol NH4NO3 时,转移5NA电子 | |
| C. | 电解质溶液中,NO3-离子向阴极移动 | |
| D. | 为了使电解产物全部转化为NH4NO3,需补充的物质A为稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com