
【题目】常温下向蒸馏水中加入冰醋酸晶体,恢复至室温,测得溶液的pH为2.下列对该溶液的叙述中不正确的是( )
A.醋酸溶液的浓度为0.01mol/L
B.由水电离出来的H+的浓度是1.0×10﹣12 mol/L
C.冰醋酸晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
【答案】D
【解析】解:A.25℃时pH=2,溶液中氢离子浓度为10﹣2mol/L,即醋酸溶液的浓度为0.01mol/L,故A正确; B.水的离子积常数为1×10﹣14 , 水电离出来的氢离子浓度等于溶液中氢氧根离子的浓度,即为 ![]() =
= ![]() =1×10﹣12mol/L,故B正确;
=1×10﹣12mol/L,故B正确;
C.加入酸或碱对水的电离起抑制作用,故C正确;
D.常温下Kw=1×10﹣14 , pH=12的NaOH溶液中氢氧根离子浓度为0.01mol/L,两种溶液的体积相等,则n(H+)=n(OH﹣),反应后溶液的溶质为醋酸钠,为强碱弱酸盐,溶液显碱性,故D错误;
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】在恒温、恒容的容器中进行反应:2HIH2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
A.等于10 s
B.等于12 s
C.大于12 s
D.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者大于后者的是( ) ①C(s)+O2(g)═CO2(g);△H1 C(s)+ ![]() O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+ ![]() O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8 .
A.①
B.④
C.②③④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
2 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
3 | 1.0 | a | 3.0 | 2.0 | 5.6 |
4 | |||||
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理________________________________________。
(2)a=______,设计实验2、3的目的是______________________
(3)利用实验2中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该同学绘制图1的依据是________________________________________
②该小组同学提出的假设是_________________________________________
③请你帮助该小组同学完成实验方案,并填写表中空白。
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 再向试 管中加 入少量 固体 | 室温下 溶液颜 色褪至 无色所 需时间 /min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
④若该小组同学提出的假设成立,则其依据是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1表示酶和催化剂改变化学反应速率的原理,图2表示加入抑制剂对起始反应速率的影响。酶的抑制剂是与酶结合并降低酶活性的分子。竞争性抑制剂与底物竞争酶的活性部位,非竞争性抑制剂和酶活性部位以外的其他位点结合,从而抑制酶的活性。请回答下列问题。
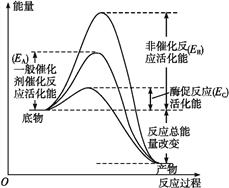 图1
图1 图2
图2
(1)由图1可知,该酶降低的活化能是______(用图中字母表示),与无机催化剂相比______________________,因而催化效率更高。
(2)活细胞产生酶的场所有________,需要的原料是________。
(3)图2中对照组是____曲线的结果,其中b为加入_____抑制剂的曲线,判断理由是_________________。请在图2中画出加入该酶的激活剂的曲线。________________
(4)信号肽假说认为,编码分泌蛋白的mRNA在翻译时首先合成的是N末端带有疏水氨基酸残基的信号肽,它被内质网膜上的受体识别并与之相结合。信号肽经由膜中蛋白质形成的孔道到达内质网内腔,但蛋白质转到高尔基体加工时却没有了该信号肽序列。据此我们可以推断内质网中可能存在的酶及作用是_______________。
(5)蛙的红细胞合成酶所需要的ATP主要由_______(过程)产生。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.保持体积不变,增加H2O(g)的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入Ar使压强增大
D.保持压强不变,充入Ar使体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: C(s)+O2(g)═CO2(g)△H1
CO2(g)+C(s)═2CO(g)△H2
2CO(g)+O2(g)═2CO2(g)△H3
4Fe(s)+3O2(g)═2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com