
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素.其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体中,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d能级为半充满状态.请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):m-
| ||
| m |
m-
| ||
| m |
| 2M |
| (a)3NA |
| 2M |
| (a)3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届浙江省杭州市建人高复学校高三第二次月考化学试卷(带解析) 题型:计算题
(10分)(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(2)已知:C3H8(g ) ==== CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如右表:已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省丹东市宽甸二中高一下学期学期初摸底化学试卷(带解析) 题型:填空题
某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O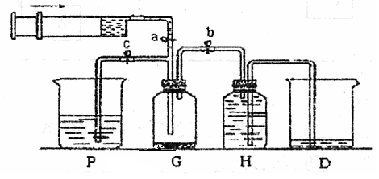
试回答下列问题:
(1)在反应2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O中,HCl体现的性质为________和_________.当生成的Cl2的体积5.6L(标准状况下),求转移的电子的个数________(阿伏伽德罗常数用NA来表示)
(2)装置H中盛放的试剂是 。装置P中盛放的试剂是 。
(3)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(4)处理尾气时,发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高一下半期考试化学试卷(解析版) 题型:选择题
阿伏伽德罗常数用NA表示,则下列叙述中正确的是( )
A.0.1 mol Na2O2中所含的阴离子数为0.2NA
B.常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA
C.标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA
D.Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com