
| A. | 0.2 mol/L的CH3COOH溶液与0.1 mol/L CH3COOH溶液中c(H+)之比为2:1 | |
| B. | 0.1 mol/L NaHCO3溶液中,c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 0.1 mol/L 的NaHA溶液,其pH=4,则c(HA-)>c(A2-)>c(H2A) | |
| D. | 只含Na+、CH3COO-、H+、OH-的酸性溶液中,c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
分析 A.醋酸浓度越大,醋酸的电离程度越小,则前、后醋酸溶液中氢离子浓度之比小于2:1;
B.根据碳酸氢钠溶液中的物料守恒判断;
C.溶液呈酸性,则c(H+)>c(OH-),说明HA-的电离程度大于其水解程度,则c(A2-)>c(H2A);
D.c(H+)>c(CH3COO-)>c(Na+)>c(OH-)违反的电荷守恒.
解答 解:A.0.2 mol/L的CH3COOH溶液与0.1 mol/L CH3COOH溶液中,前者醋酸浓度较大,醋酸的电离程度较小,则前后溶液中c(H+)之比小于2:1,故A错误;
B.0.1 mol/L NaHCO3溶液中,根据物料守恒可得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故B错误;
C.0.1 mol/L 的NaHA溶液的pH=4,说明HA-的电离程度大于其水解程度,则c(A2-)>c(H2A),溶液中离子浓度大小为:c(HA-)>c(A2-)>c(H2A),故C正确;
D.只含Na+、CH3COO-、H+、OH-的酸性溶液中:c(H+)>c(OH-),根据核电荷数可知:c(CH3COO-)>c(Na+),该溶液应该醋酸钠与醋酸的混合液,则c(CH3COO-)>c(H+),溶液中正确的离子浓度大小可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)或c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 用乙醇和浓硫酸制乙烯 | B. | 用电解水获得的氢气来合成氨 | ||
| C. | 用晒盐后的卤水制溴单质 | D. | 用氢氧化钠和二氧化碳制碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2 | |
| B. | Al3+$\stackrel{过量氨水}{→}$Al${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 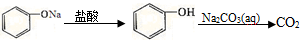 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上海属“水质性缺水”,保护水资源刻不容缓 | |
| B. | 提倡节水产业,加强废水处理 | |
| C. | 只喝桶装水或功能性饮料以保证饮用水质量 | |
| D. | 用再生水灌溉城市绿地 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
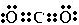 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难失去电子的原子,易形成阴离子 | |
| B. | 只有化合物分子中才存在共价键 | |
| C. | 共价分子中所有原子都具有8电子稳定结构 | |
| D. | 含氧酸的组成中可以含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
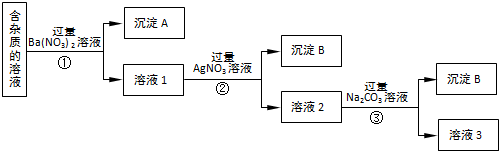
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com