
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
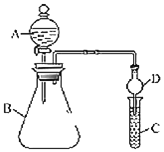
(1)仪器A的名称为______,干燥管D的作用为______。
(2)若要证明非金属性:![]() ,C中为淀粉
,C中为淀粉![]() 碘化钾混合溶液,B中装有
碘化钾混合溶液,B中装有![]() 固体,则A中试剂为______,观察到C中溶液______
固体,则A中试剂为______,观察到C中溶液______![]() 填现象
填现象![]() ,即可证明。从环境保护的观点考虑,此装置缺点______。
,即可证明。从环境保护的观点考虑,此装置缺点______。
(3)若要证明非金属性:![]() ,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
【答案】分液漏斗 防止倒吸 浓盐酸 溶液变蓝色 在装置最后添加盛有碱液的尾气吸收装置 硫酸 ![]() 溶液 硅酸钠溶液
溶液 硅酸钠溶液 ![]()
【解析】
(1)根据仪器A的构造判断其名称;尾气处理装置中,有缓冲装置的能防止倒吸;
(2)浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成![]() ,
,![]() 能氧化
能氧化![]() 生成
生成![]() ,碘遇淀粉试液变蓝;氯气有毒,图示装置中缺少尾气处理装置;
,碘遇淀粉试液变蓝;氯气有毒,图示装置中缺少尾气处理装置;
(3)元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,若要证明非金属性:![]() ,则需要证明酸性强弱顺序为:硫酸
,则需要证明酸性强弱顺序为:硫酸![]() 碳酸
碳酸![]() 硅酸,利用强酸制弱酸的原理分析即可。
硅酸,利用强酸制弱酸的原理分析即可。
(1)仪器A的名称为分液漏斗;尾气处理装置中,有缓冲装置的能防止倒吸,干燥管有缓冲作用,所以能防止倒吸;
故答案为:分液漏斗;防止倒吸;
(2)浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成![]() ,则A中试剂为浓盐酸;
,则A中试剂为浓盐酸;![]() 具有氧化性,能氧化
具有氧化性,能氧化![]() 生成
生成![]() ,碘遇淀粉试液变蓝色,C装置中看到的现象是溶液变蓝色;氯气有毒,需要添加尾气吸收装置,可以用碱液吸收氯气,所以改进措施为:在装置最后添加盛有碱液的尾气吸收装置;
,碘遇淀粉试液变蓝色,C装置中看到的现象是溶液变蓝色;氯气有毒,需要添加尾气吸收装置,可以用碱液吸收氯气,所以改进措施为:在装置最后添加盛有碱液的尾气吸收装置;
故答案为:浓盐酸;溶液变蓝色;在装置最后添加盛有碱液的尾气吸收装置;
(3)证明非金属性:![]() ,则需要证明酸性强弱顺序为:硫酸
,则需要证明酸性强弱顺序为:硫酸![]() 碳酸
碳酸![]() 硅酸,根据强酸制弱酸的原理可知A中试剂为稀硫酸,B中试剂为碳酸钠,C中试剂为硅酸钠溶液,C中硅酸钠溶液中通入CO2气体,有白色胶状沉淀生成,发生反应的化学方程式为
硅酸,根据强酸制弱酸的原理可知A中试剂为稀硫酸,B中试剂为碳酸钠,C中试剂为硅酸钠溶液,C中硅酸钠溶液中通入CO2气体,有白色胶状沉淀生成,发生反应的化学方程式为![]() ;
;
故答案为:硫酸;![]() 溶液;硅酸钠溶液;
溶液;硅酸钠溶液;![]() 。
。


科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息,得出的结论不正确的是


A. 图1表示常温下向体积为10 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a
C. 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ·mol-1
D. 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算机芯片是一种用硅材料制成的薄片,其大小仅有手指甲的一半。一个芯片是由几百个微电路连接在一起的,体积很小,在芯片上布满了产生脉冲电流的微电路。计算机芯片利用这些微电流,就能够完成控制计算机、计算机自动化装置和其它各种设备所需要的操作。高纯硅是制备半导体材料的重要物质,工业上制备纯硅的方程式为:①![]() ②
②![]() ③
③![]() ;
;
![]() 的反应属于( )
的反应属于( )
A.置换反应B.化合反应C.分解反应D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常量的值,最早由奥地利化学及物理学家Johann JosefLoschmidt测得,有时候用上代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1 g的11B中,含有0.5 NA个质子
B.pH=1的H3PO4溶液中,含有0.1 NA个H+
C.标准状态下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D.1 L 1 mol/L NaCl溶液和1 L 1 mol/L NaF溶液中离子总数:前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是科技、生产、生活中应用最广泛的金属材料。

现有铁、铝的混合物进行如下实验:
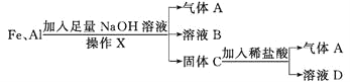
(1)操作X的名称是_____。
(2)气体A是_____。
(3)A与Cl2混合光照可能发生爆炸,生成_____(填化学式),A在该反应中作为_____(填“氧化剂”或“还原剂”)。
(4)溶液B中阴离子除OH-外还有_____,溶液D中存在的金属离子为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应3H2(g) + N2(g)![]() 2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )
2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( )
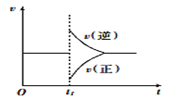
A.维持温度,反应体系体积不变,t1时充入NH3(g)
B.维持温度、压强不变,t1时充入NH3
C.维持温度不变,t1时扩大反应体系体积
D.维持压强不变,t1时升高反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述及解释正确的是
A.2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B.H2(g)+I2(g)![]() 2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C.对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡左移
2NH3,平衡后,压强不变,充入O2,平衡左移
D.FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿![]() 主要成分
主要成分![]() 是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。下列有关说法不正确的是
是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。下列有关说法不正确的是

A.发生反应a时,![]() 被氧化时消耗标准状况下空气的体积大约
被氧化时消耗标准状况下空气的体积大约![]()
B.为了验证b溶液中含![]() ,可选用KSCN溶液和氯水
,可选用KSCN溶液和氯水
C.取10 mL b溶液测定其成分,通入标准状况下![]() 22.4 mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则b溶液中
22.4 mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则b溶液中![]()
D.现有一含有![]() 和
和![]() 的混合样品,采用一定方法测得
的混合样品,采用一定方法测得![]() ,则该样品中
,则该样品中![]() 的物质的量分数为
的物质的量分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是__________________________;乙的作用是__________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。集气瓶中收集到的气体的主要成分是__________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入________________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________________(填实验操作名称)即可除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com