
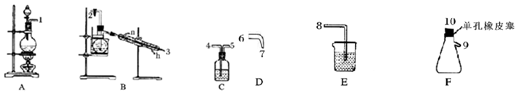
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
分析 (1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,据此排序;
(2)氯气、氯化氢都能引起空气污染,不能直接排放,应进行尾气处理,依据氯气性质选择合适的除杂剂;
(3)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,可知控制蒸馏温度范围;
(4)NCl3本身无漂白性,与水反应生成次氯酸和氨气,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色,据此解答.
解答 解:(1)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:1、4、5、2、3、6、7、10、9、8,
故答案为:4、5 10、9、8;
(2)氯气中含有氯化氢通过饱和食盐水除去,
故答案为:除去氯气中氯化氢气体;
(3)B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,还生成HCl,反应方程式为:3Cl2+NH4Cl═NCl3+4HCl;加热蒸馏出NCl3,NCl3的沸点为71℃,在95℃爆炸,所以应控制蒸馏温度为71~95℃,
故答案为:3Cl2+NH4Cl═NCl3+4HCl;71~95℃;
(4)NCl3本身无漂白性,与水反应生成次氯酸和氨气,化学方程式:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;
故答案为:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色.
点评 本题考查物质制备与性质探究实验,关键是理解实验原理和各装置作用,侧重考查学生实验能力、分析能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,H2S浓度增加,表明该反应的△H>0 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 5 | C. | 7 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
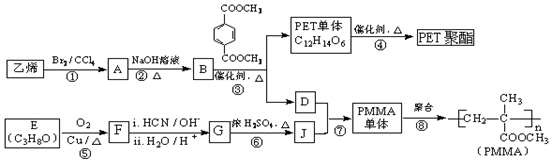
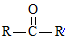 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$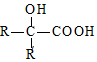 (R、R′代表烃基)
(R、R′代表烃基) .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
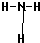 ,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.
,F的氢化物比同主族相邻元素的氢化物的沸点高,其原因是H2O分子间存在氢键.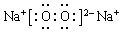 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | 只有① | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 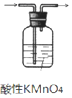 用图 1所示装置除去乙烯中少量 SO2 气体 | |
| B. |  用图 装置量取 20.00 mL 0.10 mol•L-1硫酸 | |
| C. | 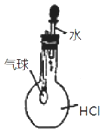 用图 装置能验证 HCl 气体在水中的溶解性 | |
| D. | 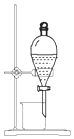 用图 装置从碘的 CCl4溶液中分离出碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
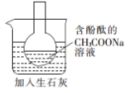 | 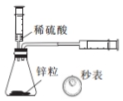 | 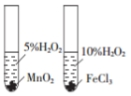 |  |
| 探究温度对盐的水解反应的影响 | 测定一定时间内生成H2的反应速率 | 比较不同催化剂对反应速率的影响 | 量取15.00mL稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com