
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
分析 活泼金属与活泼非金属元素一般形成离子键;金属单质是由金属键形成的金属晶体;根据元素在周期表中的位置判断价电子数;同周期从左到右阳离子半径依次减小.
解答 解:活泼金属与活泼非金属元素一般形成离子键,则NaCl、KCl、CaCl2均是由离子键构成的离子晶体;金属单质是由金属键形成的金属晶体,主族元素的价电子数等于其族序数,则Na的价电子数为1,Mg的价电子数为2,Al的价电子数为3,故价电子数由少到多的顺序是Na<Mg<Al;同周期从左到右阳离子半径依次减小,则粒子半径由大到小的顺序是Na+>Mg2+>Al3+.
故答案为:离子;离子;金属键结合而成;金属;Na<Mg<Al;Na+>Mg2+>Al3+.
点评 本题考查了化学键、晶体、离子半径大小比较,题目难度不大,注意把握微粒半径大小比较方法.


科目:高中化学 来源: 题型:解答题
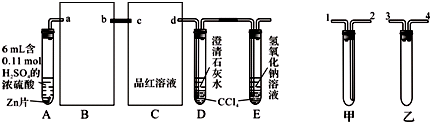
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
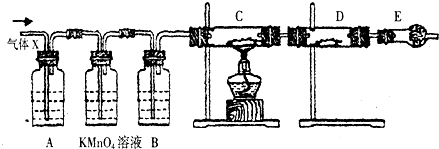
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水使湿润的红色石蕊试纸变蓝:NH3•H2O?NH4++OH- | |
| B. | 工业上用过量的NaOH溶液吸收:SO2:SO2+OH-=HSO3- | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用石灰乳吸收泄露的氯气:Ca(OH)2+Cl2=Ca2++Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
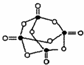 所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH
所示.P4 O10极易与水反应,反应过程可表示为如下形式;P-O-P+H2O→2P-OH (PAN)等二次污染物.
(PAN)等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com