
【题目】下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )
①升高温度;②增大压强;③增大反应物的物质的量;④将块状固体反应物磨成粉末
A.①②③④B.①④C.①③④D.①②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
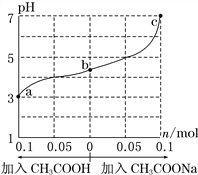
A. b点混合液中c(Na+)>c(CH3COO-)
B. 加入CH3COOH过程中,![]() 增大
增大
C. c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:

请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:空气→Ⅳ→________→________→________(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。____________
(2)装置Ⅳ中盛放的药品是___________,其作用是____________________。
(3)装置Ⅱ的作用是_________________________________________。
(4)操作中通空气和加热的先后顺序为_______________________________。
(5)加热装置Ⅰ时发生反应的化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硅是制造太阳能电池的材料
B.SO2具有氧化性,可用于漂白纸浆
C.AlCl3可用作冶炼金属铝
D.医学上常用碳酸钡作为内服造影剂“钡餐”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车内燃机工作时会引起N2和O2的反应:N2+O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
(1)在T1、T2温度下,一定量的NO(g)发生分解反应时,N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H_____0(填“>"或“<”)。
2NO(g)的△H_____0(填“>"或“<”)。
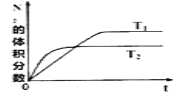
(2)在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=_________。该温度下,若增大压强此反应的平衡常数将_________(填“增大”、“减小”、“不变”或“无法确定”),若向上述容器中再充入2molN2(g)与1molO2(g),则再次达到平衡时O2的转化率________(填“增大”、“减小”、“不变”或“无法确定”)。
(3)研究发现,用CH4催化还原NOx可以消除氮氧化物的污染,从而达到脱硝的目的:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJmol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJmol-1
甲烷直接被NO2还原为N2的热化学方程式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的离子积常数Kw与温度T(℃)有关:
(1)若T=25℃时,Kw=____________,若T=100℃时,Kw=1×10-12,则此温度下0.05mol/LBa(OH)2 溶液的pH=____________.
(2)已知25℃时,0.1L 0.1molL-1的NaA溶液的pH=10,用离子方程式表示其原因为______________;
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为_____________(混合后的体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.2 g铁粉与2.2 g硫粉均匀混合,在密闭容器中加热,冷却后加入足量盐酸,在标准状况下收集到气体的体积是( )
A. 11.2 L B. 5.6 L C. 4.48 L D. 2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸H2A溶液中滴加NaOH溶液,所得混合溶液pH与离子浓度变化如图所示,下列说法正确的是( )

A. 直线M表示pH与lg![]() 的变化关系
的变化关系
B. Ka2(H2A)=10-4.3
C. 交点e的溶液中:c(H2A)=c(A2-)>c(HA-)>c(H+)>c(OH-)
D. f点溶液中:c(H+)-c(OH-)=c(HA-)+c(A2-)-c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
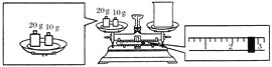
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
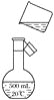
①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com