
常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中的关系正确是
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:阅读理解
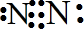
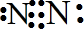
| ||
| ||
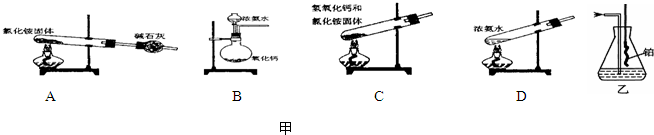 ②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
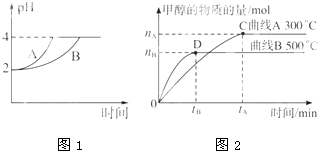
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| O | 2-3 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西大学附中高二(上)期中化学试卷(理科)(解析版) 题型:填空题
 ,经计算 (填”有”或”无”)Mg(OH)2沉淀生成.
,经计算 (填”有”或”无”)Mg(OH)2沉淀生成. 水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).
水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).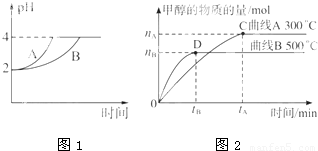
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com