
肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的:( )
A.正极的电极反应式:O2+4H++4e—=2H2O
B.溶液中的阴离子向正极移动
C.溶液的pH值保持不变
D.负极的电极反应式:N2H4+4OH—-4e—=4H2O+N2
科目:高中化学 来源: 题型:
在电子工业中,制作电路时,常用氯化铁溶液作为铜的腐蚀液,该过程发生的反应为:2FeCl3 + Cu == 2FeCl2 + CuCl2。该反应利用了铜的性质中的
A.氧化性 B.还原性
C.导电性 D.导热性
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 mol X水解得到1 mol Y和1 mol CH3CH2OH,X、Y的分子量都不超过200,完全燃烧都只生成CO2和H2O。且X分子中碳和氢元素总的质量百分含量约为81.8%。
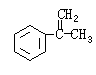 (1) X、Y相对分子质量之差为__________。(2)1个Y分子中应该有_______个氧原子。
(1) X、Y相对分子质量之差为__________。(2)1个Y分子中应该有_______个氧原子。
(3) X的分子式是_________ ______。
(4) G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
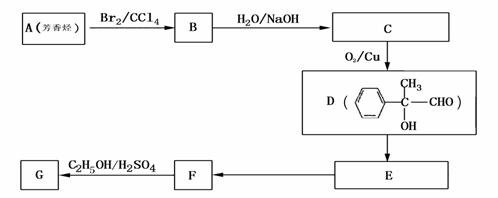
① 写出A的结构简式
② E→F的反应类型是 反应,该反应的化学方程式为: 。
③ 写出所有符合下列条件的F的同分异构体的结构简式: 。
ⅰ.分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。
ⅱ.一定条件下,该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是:( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时放正极
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2==2H2O,下列有关说法不正确的是:( )

A. H2通过多孔电极时能增大H2的接触面积,加快反应
B. a极上的电极反应式为:O2+2H2O+4e—==4OH—
C. 每转移0.1 mol电子,消耗标准状况下的H2 1.12 L[
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
I、有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中除稀有气体外电负性最小的元素 |
(1)B原子最外层共有 种不同运动状态的电子,
(2)C的第一电离能比F 的 (填“大”或“小”),
(3)D与E可形成 DE3分子,其 中心原子的杂化方式为 ,其空间构型为 。
II、原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3 +5 | -2 +6 | -1 +7 | +2 | +1 +2 |
| 原子半径 | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
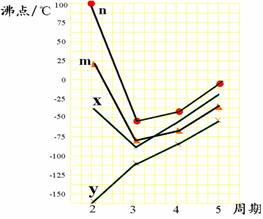 (1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)F2+与NH3 形成配离子时提供空轨道的为 (填写微粒的化学式);往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成深蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式 。
(3)图中四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出字母C所对应元素的氢化物所在的折线 (填n、m、x或y)。
查看答案和解析>>
科目:高中化学 来源: 题型:
盛有BaCl2溶液的甲、乙两试管分别通入SO2气体至饱和,若向甲试管中加入足量H2O2(双氧水),乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
A.甲、乙两试管都有白色沉淀生成
B.甲、乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀生成而乙试管有
D.甲试管有白色沉淀生成而乙试管没有
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
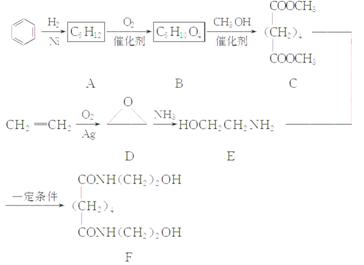
(1)B的结构简式是________;E中含有的官能团名称是________。
(2)由C和E合成F的化学方程式是_______________________________。
(3)同时满足下列条件的苯的同分异构体的结构简式是________。
①含有3个双键 ②核磁共振氢谱只显示1个吸收峰 ③不存在甲基
(4)乙烯在实验室可由________(填有机物名称)通过________(填反应类型)制备。
(5)下列说法正确的是( )
a.A属于饱和烃 b.D与乙醛的分子式相同
c.E不能与盐酸反应 d.F可以发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com