
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )。
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO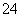
B.1.0 mol·L-1的NaAlO2溶液:Cl-、HCO 、K+、Ba2+
、K+、Ba2+
C.1.0 mol·L-1的FeCl2溶液:NO 、Na+、K+、ClO-
、Na+、K+、ClO-
D.澄清透明的溶液:Cu2+、SO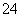 、Mg2+、Cl-
、Mg2+、Cl-
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论的叙述正确的是 ( )。

| 选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
| A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
| B | Cu | Zn | 稀 H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
| C | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
| D | C | C | FeCl3 | KI、淀粉 混合液 | 若开始时只增大FeCl3溶液浓度,b极附近溶液变蓝的速度加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能够说明一个可逆反应H2(g)+I2(g)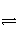
 2HI(g)已达到平衡状态的是( )
2HI(g)已达到平衡状态的是( )
A.1 mol H—H键断裂的同时有1 mol H—I键形成
B.1 mol H—H键断裂的同时有2 mol H—I键形成
C.1 mol I—I键断裂的同时有2 mol HI键形成
D.1 mol H—H键断裂的同时有1 mol I—I键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号)。峰的强度与结构中的H原子数成正比,例如乙酸分子的PMR谱中有两个信号峰,其强度为3:1。现有某化学式为C3H6O2的有机物的PMR谱有三个峰,其强度比为3:2:1,则该有机物的结构简式不可能是( )
A.CH3CH2COOH B.CH3COOCH3
C.HCOOCH2CH3 D.CH3COCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对各组离子或物质是否能够大量共存解释正确的是
( )。
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | c(OH-)=1.0×10-13 mol·L-1溶液中,Fe2+、NO | 不能共存 | 发生反应:3Fe2++NO |
| C | 溶液中:K+、Cu2+、Cl-、NH3·H2O | 不能共存 | 发生反应:Cu2++2OH-===Cu(OH)2↓ |
| D | 溶液中:Al3+、Na+、SO | 可以共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO 、CO
、CO 、SO
、SO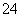 、I-、SiO
、I-、SiO 、MnO
、MnO 中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
(1)根据下列实验步骤和现象,推断实验结论:
| 实验步骤与实验现象 | 实验结论 |
| Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是____________ |
| Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是__________________________,一定含有的离子是________ |
| Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是________,生成沉淀A的离子方程式为___________________ |
| Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有_____ __,可能含有________________ |
(2)上述实验步骤Ⅳ中开始阶段发生反应的离子方程式一定有____________。

(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示。
Y可能为______________________。B的组成为_______________________。
(4)已知氢氧化铝电离出H+比碳酸氢钠电离出H+更难。根据上述推断,取少量原溶液于试管中,向试管中滴加少量硫酸氢钠稀溶液至过量,按先后顺序可以观察到的现象有_____________________________________________。
写出最后发生反应的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是中学常见的混合物分离或提纯的基本装置。
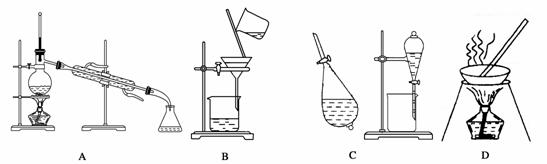
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3__________________________________________;
(2)从碘水中提取碘__________________________________________;
(3)用自来水制取蒸馏水___________________________________;
(4)分离植物油和水_______________________________________;
(5)除去粗盐中的泥沙__________________________________________;
(6)与海水晒盐原理相符的是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
防止钢铁的腐蚀是世界级难题,每年全世界钢产量的四分之一因腐蚀而损失,根据下图回答:
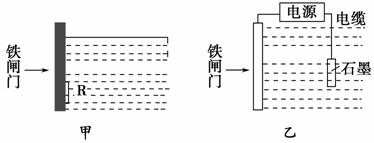
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为________________________________________________________________。
(2)为降低某水库的铁闸门的被腐蚀速率,可以采用图甲方案,其中焊接在铁闸门上的固体材料R可以采用__________。
A.铜 B.钠 C.锌 D.石墨
(3)图乙所示方案也可降低铁闸门的被腐蚀速率,其中铁闸门应该连接在直流电源的________极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com