
【题目】下图是元素周期表的一部分
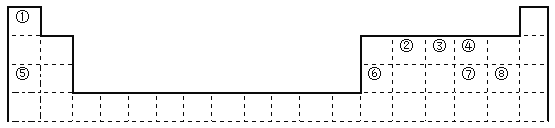
(1)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(2)②在元素周期表的位置是________________________。
(3)比较④、⑤常见简单离子的半径的大小(用化学式表示,下同)____________;⑦、⑧的最高价氧化物对应的水化物的酸性强弱是:____________。
(4)②③④三种元素都可以与元素①形成化合物,其稳定性顺序为___________________,其沸点由低到高的顺序为___________________(用化学式表示)。
(5)元素⑥的最高价氧化物的水化物与元素⑤⑦最高价氧化物的水化物都能发生反应,写出反应的离子方程式__________________________,________________________。
【答案】Na O 第二周期 ⅣA族 r(O2-)>r(Na+) HClO4>H2SO4 H2O>NH3>CH4 CH4﹤NH3﹤H2O Al(OH)3+3H+=Al3++3H2O Al(OH)3 +OH-=AlO2-+2H2O
【解析】
根据元素在周期表中的相对位置可知①~⑧分别是H、C、N、O、Na、Al、S、Cl,则
(1)根据元素周期律可知表中最活泼的金属是Na,非金属性最强的元素是O;(2)②是碳元素,在元素周期表的位置是第二周期ⅣA族。(3)核外电子排布相同时离子半径随原子序数的增大而减小,则④、⑤常见简单离子的半径的大小顺序为r(O2-)>r(Na+);氯元素非金属性强于硫元素,非金属性越强,最高价含氧酸的酸性越强,所以⑦、⑧的最高价氧化物对应的水化物的酸性强弱是HClO4>H2SO4。(4)非金属性越强,氢化物越稳定,则②③④三种元素形成的氢化物稳定性顺序为CH4<NH3<H2O,由于水分子间、氨气分子间均存在氢键,所以其沸点由低到高的顺序为H2O>NH3>CH4。(5)元素⑥的最高价氧化物的水化物氢氧化铝与元素⑤⑦最高价氧化物的水化物氢氧化钠、硫酸都能发生反应,反应的离子方程式分别是Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O。


科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图一装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A (A下端活塞关闭)中。
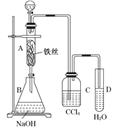
(1)写出A中反应的化学方程式________________。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________,写出有关的化学方程式___________________。
(3)C中盛放CCl4的作用是____________________。
(4)若证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入___________,现象是_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含有非极性键的分子一定是非极性分子
B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子
D. 两个原子之间共用两对电子,形成的化学键一定有极性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是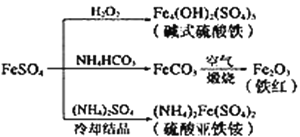
A. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A. 标况下,22.4 L氧气的分子数为NA
B. 100 g质量分数为98%的浓硫酸中所含氧原子数为4NA
C. 常温常压下,42 g C2H4和C3H6的混合气体含有的H原子数为6NA
D. 18 g NH4+含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。

① 下列对尼泊金酯的判断不正确的是______。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.与浓溴水反应时,1 mol尼泊金酯消耗1 mol Br2
e.1 mol尼泊金酯与足量浓溴水反应后,使其有机产物与NaOH溶液反应,则最多消耗6 mol NaOH溶液。
② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是____________________________,其中包含的反应类型有_________________、________________。
(2)C8H8O3的另一种同分异构体甲满足以下条件:① 与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH,② 遇FeCl3溶液显色,③ 苯环上的一氯取代物只有一种。
甲可能的结构简式是_______________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检测明矾样晶(含砷酸盐)中的砷含量是否超标,实验装置如下图所示(夹持装置已略去)。
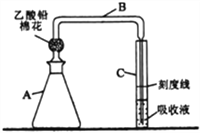
【实验1】配制砷标准溶液
①取0.132gAg2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷);
②取一定量上述溶液,配制1L含砷量为1mg·L-1的砷标准溶液。
(1)步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒外,还有__________。步骤②需取用步骤①中Na3AsO3溶液____mL。
【实验2】制备砷标准对照液
①往A瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI溶液和SnCl2溶液,混匀,室温放置10 min,使砷元素全部转化为H3AsO3。
②往A瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管B,并使B管右侧末端插入比色管C中银盐吸收液的液面下,控制反应温度25~40℃,45 min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,向其中添加氯仿至刻度线,混匀,得到砷标准对照液。
(2)乙酸铅棉花的作用是_____________________。
(3)完成生成砷化氢反应的离子方程式:
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
(4)控制A 瓶中反应温度的方法是________________________;反应中,A瓶有较多氢气产生,氢气除了搅拌作用外,还具有的作用是_____________________________。
(5)B管右侧末端导管口径不能过大(约为1mm),原因是__________________________。
【实验3】判断样品中砷含量是否超标
称取ag明矾样品替代【实验2】 ①中“2.00m砷标准溶液”,重复【实验2】后续操作。将实验所得液体与砷标准对照液比对,若所得液体的颜色浅,说明该样品含砷量未超标,反之则超标。
(6)国标规定砷限量为百万分之二(质量分数),则a的值为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com