
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
分析 同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知原子序数的关系为X>Y>Z,根据同主族非金属性的递变规律比较.
解答 解:A.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,根据酸性相对强弱:H3XO4<H3YO4<H3ZO4,可知原子序数的关系为X>Y>Z,故A错误;
B.元素非金属性越强,则对应氢化物的稳定性越强,则气态氢化物的稳定性:XH3<YH3<ZH3,故B正确;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,则可知非金属性X<Y<Z,故C错误;
D、同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物对应水化物的酸性逐渐减弱,电子层数逐渐增多,所以电子层数:Y<X,故D正确.
故选BD.
点评 本题考查了同主族元素性质的相似性和递变性,把握元素周期律为解答本题的关键,注意归纳非金属性比较的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
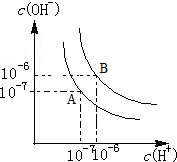 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol | |
| B. | 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- | |
| C. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | |
| D. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
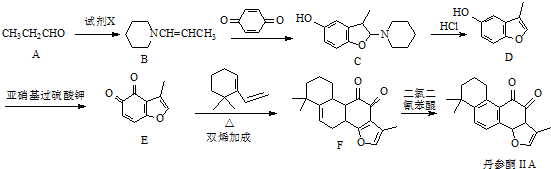
 .
. .
.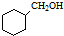 的合成路线流程图(无机试剂可任选).
的合成路线流程图(无机试剂可任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
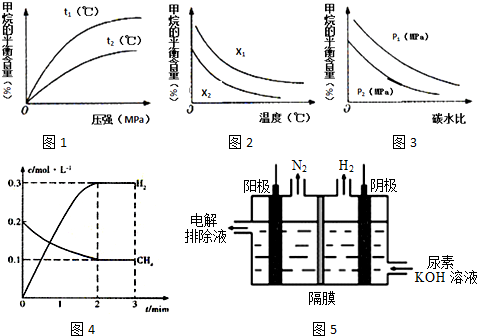
| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| t1 | 0.18 | 0.38 | 0.22 | 0.66 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com