
| A. | Mg比Al活泼,Mg失去电子被氧化为Mg2+ | |
| B. | 负极反应式为Al-3e-+4OH-═AlO2-+2H2O | |
| C. | 原电池工作过程中溶液pH不变 | |
| D. | Al是电池正极,开始工作时溶液中会立即有白色沉淀析出 |
分析 该原电池中,铝易失电子作负极,电极反应式为Al+4OH--3e-=AlO2-+2H2O,正极上水得电子发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-,电池反应式为2Al+2OH-+2H2O=3H2↑+2AlO2-,据此分析解答.
解答 解:A.在NaOH溶液中,铝能与NaOH溶液发生氧化还原反应,在该反应中,铝失电子作原电池的负极,而属镁和氢氧化钠溶液不能发生氧化还原反应,故A错误;
B.负极上电极反应式为Al+4OH--3e-=AlO2-+2H2O,故B正确;
C.电池总反应式为2Al+2OH-+2H2O=3H2↑+2AlO2-,氢氧根被消耗,PH值减小,故C错误;
D.铝作负极,开始工作时氢氧化钠过量,电极反应为Al+4OH--3e-=AlO2-+2H2O,所以没有白色沉淀生成,故D错误;
故选B.
点评 本题考查了原电池工作原理,为高频考点,侧重学生分析能力的考查,正确判断原电池正负极是解本题的关键,注意不能只根据金属的活泼性强弱判断正负极,要结合电解质溶液的酸碱性来判断,题目难度中等.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
| A. |  测定反应生成氢气的速率 | B. |  模拟海水中铁打的防护 | ||
| C. |  证明碳酸氢钠热稳定性差 | D. |  制备乙酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡含离子键的物质中,一定含有金属元素 | |
| B. | 非金属元素的原子间不可能形成离子化合物 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 共价化合物中只含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③ | B. | 仅①②③ | C. | 仅①③⑥ | D. | 全部都可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .有机物X的键线式为
.有机物X的键线式为  ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为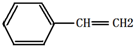 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应,可生成环状的饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B、C物质的分子数之比为1:3:2 | |
| B. | 容器内气体的密度不再随时间而改变 | |
| C. | 容器内气体的压强不再随时间而改变 | |
| D. | 单位时间内生成a mol物质A,同时生成3a mol物质B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6mol | B. | 2.5mol | C. | 3mol | D. | 4.8mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com