
| A、V(A)平:V(B)平=5:3 |
| B、A的转化率为20% |
| C、x:y=2:1 |
| D、D的反应速率为0.25 mol/(L?min) |
| 0.5mol/L |
| 2min |
| 0.5mol/L |
| 2min |
| 1 |
| 5 |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、已知常温下,物质的量浓度相等的CH3COONa与CH3COOH混合液的pH<7,在此溶液中继续加CH3COONa至pH=7,测得此时c(Na+ )=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
| B、0.01 mol?L-1的Na2HPO4溶液中存在如下的平衡:HPO42-+H2O?H2PO4-+OH- HPO42-?H++PO43- 且溶液pH>7;加水稀释后溶液中HPO42-、PO43-、H+的浓度均减小 |
| C、图中,Y轴S表示相应金属氢氧化物在饱和溶液中阳离子的浓度,由图中数据可计算出室温下Ksp[Cu(OH)2]=1.0×10-12 |
| D、由图可知,若Fe(NO3)3溶液中含有少量的Co2+杂质,可通过加入Fe(OH)3的方法来除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 灼烧 |
B、 过滤 |
C、 分液 |
D、 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
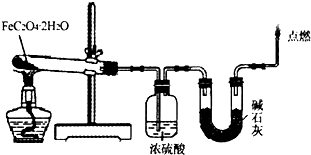 (1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题
(1)取一定质量H2C2O4?2H2O和KHC2O4的混合物,加水溶解,配成250mL溶液,取两份此溶液各25mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25mol?L-1 NaOH溶液至20.00mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3mol?L-1H2SO4溶液酸化后,用0.10mol?L-1KMnO4溶液滴定,消耗KMnO4溶液16.00mL时达到终点.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①⑤ | B、④⑤ | C、①② | D、③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com