
| 128 |
| 12 |
 ;
; ;
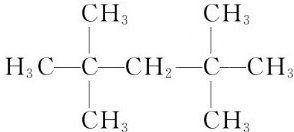
; 可看做乙烯中的四个氢原子被甲基取代;乙炔是直线型分子,CH3C≡CCH3可看做是甲基取代乙炔分子上的氢原子,
可看做乙烯中的四个氢原子被甲基取代;乙炔是直线型分子,CH3C≡CCH3可看做是甲基取代乙炔分子上的氢原子, ;CH3C≡CCH3;
;CH3C≡CCH3;| 128-10 |
| 12 |
| 128-20 |
| 12 |
| 18 |
| 3 |
 ;
; ,
, ;
; .
.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| A、AgNO3[Ag2CO3] |
| B、NaOH[NaOH] |
| C、NaCl[稀HCl] |
| D、CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |

查看答案和解析>>
科目:高中化学 来源: 题型:
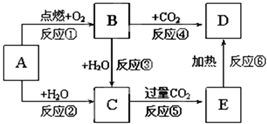 如图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:
如图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
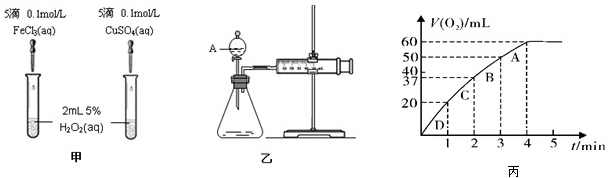
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均不变 |
| B、①增大,②不变,③减小 |
| C、均增大 |
| D、①减小,②不变,③增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com