
【题目】烃A分子内含有碳碳双键,并有如下转化关系:

请回答:
(1)E的分子式是_____________,C的结构简式是____________。
(2)反应①、②,分别属于的反应类型是①___________、②_____________
(3)写出反应B ![]() C的化学方程式__________________________________
C的化学方程式__________________________________
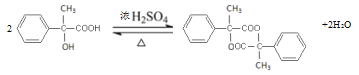
(4)写出两分子E酯化生成六元环酯的化学方程式:_______________________________________
(5)A有多种同分异构体,写出满足下列条件的一种同分异构体的结构简式:_________
a.分子中有苯环,且能使溴水褪色 b.苯环上有两个间位取代基
(6)写出E在一定条件下发生消去后的产物合成高分子的化学方程式__________________________________________________________________________________________
【答案】C9H10O3 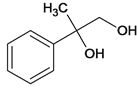 加成反应 水解反应
加成反应 水解反应 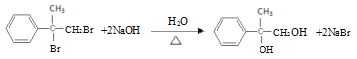

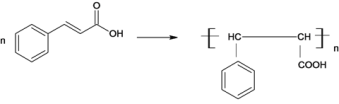
【解析】
由逆推法可得A为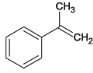 ,与溴发生加成反应生成B,B为
,与溴发生加成反应生成B,B为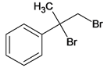 ,B在碱性条件下水解生成C,C为
,B在碱性条件下水解生成C,C为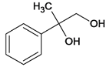 ,伯醇可催化氧化成醛,叔醇不能被氧化,得D,D为
,伯醇可催化氧化成醛,叔醇不能被氧化,得D,D为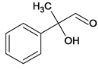 ,D在新制的氢氧化铜作用下生成E的盐,酸化后生成E
,D在新制的氢氧化铜作用下生成E的盐,酸化后生成E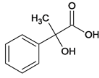 。
。
(1)E为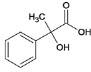 ,E的分子式是C9H10O3,C的结构简式是
,E的分子式是C9H10O3,C的结构简式是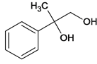 。
。
(2)反应①A为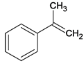 ,与溴发生加成反应生成B、②B为
,与溴发生加成反应生成B、②B为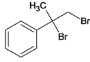 ,B在碱性条件下水解生成C,C为
,B在碱性条件下水解生成C,C为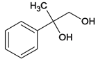 ,反应类型分别是①加成反应、②水解反应;
,反应类型分别是①加成反应、②水解反应;
(3)B为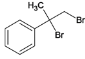 ,B在碱性条件下水解生成C,C为
,B在碱性条件下水解生成C,C为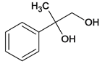 ,反应B
,反应B ![]() C的化学方程式
C的化学方程式 ;
;
(4)两分子E分子间脱水,酯化生成六元环酯的化学方程式: ;
;
(5)A有多种同分异构体,a.分子中有苯环,且能使溴水褪色,说明该异构体中含有苯环和碳碳双键;b.苯环上有两个间位取代基,-C2H3,和-CH3,满足下列条件的一种同分异构体的结构简式: 。
。
(6)E在一定条件下发生消去后的产物是: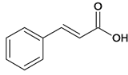 ,
, 合成高分子的化学方程式
合成高分子的化学方程式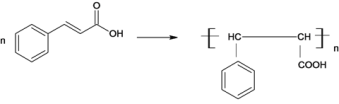


科目:高中化学 来源: 题型:
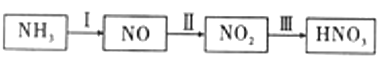
【题目】硝酸工业与合成氨工业密切相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程如图:
I. 在一容积为2L的密闭容器内加入2molN2和6molH2,在一定条件下合成氨气,已知N2(g)+3H2(g)![]() 2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示
2NH3 △H<0。反应中NH3的物质的量浓度的变化情况如图所示

(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为______
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为________(填序号)。
a. 0. 8mol/L b.1.0mol/L. c.1.2mol/L d. 2. mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_________(选填“大于”“等于”或“小于”)二分之一倍的原体积。
Ⅱ.某小组同学欲探究由NH3制取HNO3的过程,设计按如图所示装置进行试验。
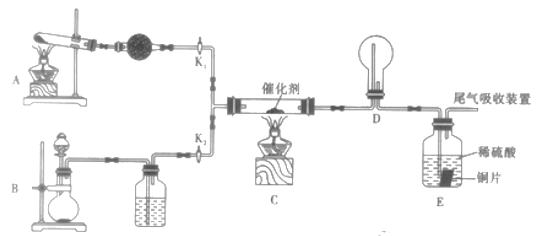
(1)A装置中发生反应的化学方程式为_________________________________。
(2)B装置制备的物质为_________________。(填序号)
A . NH3 B Cl2 C.O2 D. HCl
(3)该实验中能够证明有二氧化氮产生的现象为_______________________。
(4)已知E中装有2mol/L的硫酸150mL和足量铜片,若E中出现溶液变蓝色的现象,所有反应的铜均转化为CuSO4,则至少需要产生标况下_______L氨气(假设各步反应均完全进行)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的表示方法多种多样,下面是常见有机物的表示方法:
①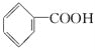 ②
②![]() ③CH4
③CH4
④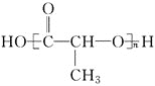 ⑤
⑤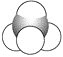
⑥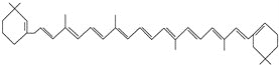
⑦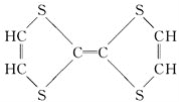
⑧ ⑨
⑨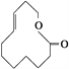
⑩
(1)上述表示方法中属于结构简式的为__________;
属于结构式的为________;
属于键线式的为________;
属于比例模型的为________;
属于球棍模型的为________。
(2)写出⑨的分子式:________。
(3)写出⑩中官能团的电子式:________、________。
(4)②的分子式为________,最简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫元素及其化合物的说法或描述正确的是
A. 硫黄矿制备硫酸经历两步:![]()
B. 酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C. 闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
D. 在燃煤中加入石灰石可减少SO2排放,发生的反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于化合反应,又属于氧化还原反应的是( )
A.Fe+2HCl=H2↑+FeCl2B.2FeCl2+Cl2=2FeCl3
C.CaO+H2O=Ca(OH)2D.2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下为中学化学中常见的几种物质:①NaOH溶液②铜丝③蔗糖晶体④无水乙醇⑤稀硫酸⑥液氨⑦氨水⑧SO2 ⑨硫酸钡晶体⑩熔融 NaC1,上述状态下可导电的________;上述状态下的电解质不能导电是__________________
(2)写出⑤和⑦发生反应的离子方程式___________________.
(3)在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量NaOH 并加热可得到c molNH3,则原溶液中 A13+的物质的量浓度为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。
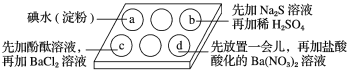
对实验现象的“解释或结论”错误的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 还原性:SO32->I- |
B | b中加硫酸后产生淡黄色沉淀 | SO32-和S2-在酸性条件下发生反应 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | SO32-+H2O |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
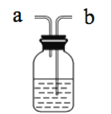
【题目】某学习小组用如图装置研究气体X的性质,气体X的主要成分是Cl2,其中含有少量水蒸气。请回答下列问题:

(1)分别描述B、C装置中的现象____;结合化学方程式及物质性质说明B、C装置中现象不同的原因____。
(2)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理____。气体应该由____(填“a”或“b”)管通入。若要吸收224mLCl2(标况下),至少需要1mol/L的上述溶液____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: ![]() 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
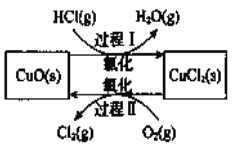
过程I的反应为,![]()
(])该原理中,![]() 的作用是_____________
的作用是_____________
(2)过程II反应的热化学方程式为____________
(3)压强为![]() 时,地康法中
时,地康法中![]() 的平衡转化率
的平衡转化率![]() 随温度变化曲线如图。
随温度变化曲线如图。
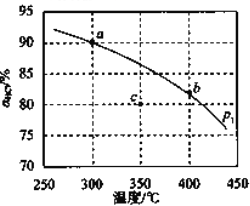
①平衡常数比较:K(a)____________K(b)(填">“<"或“-").
②c点表示投料不变,![]() 、压强为
、压强为![]() 时,地康法中HCl的平衡转化率,则p2_____________p1(填“>”“<”或“=”),理由是___________。
时,地康法中HCl的平衡转化率,则p2_____________p1(填“>”“<”或“=”),理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com