
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物,只含共价键的化合物为共价化合物,含O、F、N的氢化物含氢键,结合对称且中心原子为sp杂化的为直线分子,以此来解答.
解答 解:①Cl2为含非极性共价键的单质;
②BaCl2为含离子键的离子化合物;
③H2SO4为只含共价键的共价化合物;
④NaOH为含离子键、共价键的离子化合物;
⑤NH3为只含共价键的共价化合物,且含氢键;
⑥CO2为只含共价键的共价化合物,且为直线分子;
⑦Na2O2为含离子键、非极性共价键的离子化合物;
⑧H2O为只含共价键的共价化合物,且含氢键;
⑨H2S为只含共价键的共价化合物;
⑩NH4Cl为含离子键、共价键的离子化合物,
则含有非极性共价键的是①⑦,属于共价化合物的是③⑤⑥⑧⑨,属于离子化合物的是②④⑦⑩,属于含共价键的离子化合物是④⑦⑩,在固态或液态时存氢键的分子是⑤⑧,极性键形成的直线分子是⑥,
故答案为:①⑦;③⑤⑥⑧⑨;②④⑦⑩;④⑦⑩;⑤⑧;⑥.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律等为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:解答题
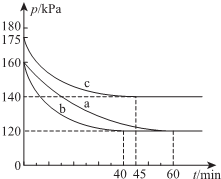 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
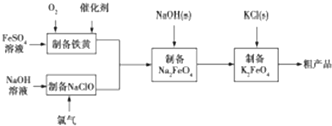
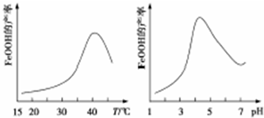
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原氨水的浓度为10-3mol•L-1 | |
| B. | 溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| C. | 氨水的电离程度增大,溶液中所有离子的浓度均减小 | |
| D. | 再加入10 mL pH=3的盐酸充分反应后混合液的pH值肯定大于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com