
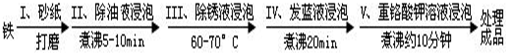
分析 (1)铁锈的主要成分为氧化铁,可与稀硫酸反应生产硫酸铁和水;
(2)如不合格,则硫酸铜溶液可与铁接触而反应;
(3)重铬酸钾将铁氧化生成氧化铁;
(4)反应一为氧化还原反应,结合电子守恒和质量守恒配平,反应一消耗NaNO2,反应二消耗NaNO3.
解答 解:(1)铁锈的主要成分为氧化铁,可与稀硫酸反应生产硫酸铁和水,则反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)铁能与硫酸铜反应生成硫酸亚铁和铜,反应的方程式为Fe+CuSO4 ═FeSO4 +Cu,故答案为:铁制品表面有红色固体析出;
(3)重铬酸钾将铁氧化生成氧化铁,表现氧化性,故答案为:氧化;
(4)反应一为氧化还原反应,铁元素化合价升高了2价,氮元素的化合价降低了6价,反应的化学方程式为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑,反应一消耗NaNO2,反应二消耗NaNO3,则要往使用过的发蓝液中只需加入NaNO2和NaNO3,
故答案为:3;1;5;3;1;1;B.
点评 本题综合考查物质的制备以及性质实验的设计,为高考常见题型,侧重考查学生的分析能力和实验能力,主要把握物质的性质以及实验的原理,题目有利于培养学生良好的科学素养,难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚 | |
| B. | 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出甘油 | |
| C. | 氨基酸为高分子化合物,种类较多,分子中都含有-COOH和-NH2 | |
| D. | 淀粉、纤维素、麦芽糖在一定条件下可与水作用转化为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c( H2CO3) | |
| C. | 向10mL0.2mol•L-1NaCl溶液中滴入2mL0.1mol•L-1AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将灼烧变黑的热铜丝插入装少量无水乙醇的试管中 | 铜丝变红 | 乙醇具有氧化性 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| D | 用硫酸做催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗1mol的H2O同时生成1mol的H2 | |
| B. | 两个H-O键断裂的同时有四个C-O键断裂 | |
| C. | 反应容器内的密度不再发生变化 | |
| D. | 混合气体的相对分子质量不发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com