
| A. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′>Q | |
| B. | S(g)+O2(g)=SO2(g)放热为Q′,则Q′<Q | |
| C. | 1mol SO2(g)的能量>1mol S(s)的能量+1mol O2(g)的能量 | |
| D. | 1mol SO2(g)的能量<1mol S(s)的能量+1mol O2(g)的能量 |
分析 根据已知S(s)+O2(g)=SO2(g)放出的热量为Q,该反应放热,则反应物具有的总能量>生成物所具有的总能量,又S(g)=S(s)为放热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)放出的能量更多,以此来解答.
解答 解:根据已知S(s)+O2(g)=SO2(g)放出的热量为Q,该反应放热,则反应物具有的总能量>生成物所具有的总能量,又S(g)=S(s)为放热过程,由盖斯定律可知,S(g)+O2(g)═SO2(g)放出的能量更多,以此来解答;
因S(g)=S(s)为放热过程,则S(g)+O2(g)=SO2(g)放出的能量更多,放热为Q′,则Q′>Q,
故A正确,B错误;
已知S(s)+O2(g)=SO2(g)放出的热量为Q,该反应放热,则反应物具有的总能量>生成物所具有的总能量,即1mol S(s)的能量+1mol O2(g)的能量>1mol SO2(g)的能量,
故C错误,D正确,
故选AD.
点评 本题考查反应放出的能量大小比较及放热反应反应物和生成物总能量的相对大小,明确放热反应的特征是解题的关键,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

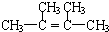 .
.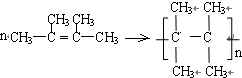 .
.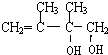 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯.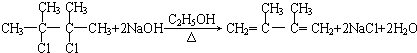 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64g | B. | 32g | C. | 64g•mol-1 | D. | 32g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
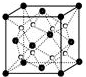 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com