
【题目】为探究苯与溴的取代反应,甲用如图所示装置进行如下实验:将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min 后发现滴有AgNO3 的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
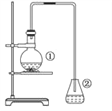
(1)装置 I 中发生的有机反应的化学方程式为___________________。
(2)①中长导管的作用是____________________。
(3)烧瓶中生成的红褐色油状物,要想得到纯净的产物,可用_____________(填试剂化学式)洗涤。
(4)由于装置的设计无法除去 HBr 气体中混有的杂质,所以甲同学认为根据锥形瓶中浅黄色沉淀生成的现 象来证明苯与溴发生了取代反应,可信程度较低。那为了增加实验的可信度,甲同学在①与②间接入一个装___________(填试剂的分子式)的洗气瓶。
【答案】 ![]() 导气、冷凝及回流 NaOH 或 H2O CCl4 或 C6H6
导气、冷凝及回流 NaOH 或 H2O CCl4 或 C6H6
【解析】(1)因溴与铁反应生成溴化铁:2Fe+3Br2═2FeBr3,苯和液溴在溴化铁的催化作用下生成溴苯和溴化氢:![]() ;(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气、冷凝及回流;(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴,可用NaOH溶液(或水)试剂洗涤,让反应生成溶于水的物质,再进行分液;(4)由于装置的设计无法除去 HBr 气体中混有的杂质,所以甲同学认为根据锥形瓶中浅黄色沉淀生成的现象来证明苯与溴发生了取代反应,可信程度较低。那为了增加实验的可信度,甲同学在①与②间接入一个装CCl4 或 C6H6的洗气瓶,以萃取反应过程中挥发出的溴单质,避免溴进入锥形瓶与水反应产生的溴离子干扰取代反应生成的溴化氢的检验。
;(2)反应为放热反应,长导管让挥发出来的溴单质冷凝,防止对产物的干扰,即长导管的作用为导气、冷凝及回流;(3)反应生成的硝基苯和溴互溶呈红褐色油状液滴,可用NaOH溶液(或水)试剂洗涤,让反应生成溶于水的物质,再进行分液;(4)由于装置的设计无法除去 HBr 气体中混有的杂质,所以甲同学认为根据锥形瓶中浅黄色沉淀生成的现象来证明苯与溴发生了取代反应,可信程度较低。那为了增加实验的可信度,甲同学在①与②间接入一个装CCl4 或 C6H6的洗气瓶,以萃取反应过程中挥发出的溴单质,避免溴进入锥形瓶与水反应产生的溴离子干扰取代反应生成的溴化氢的检验。


科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是 ( )
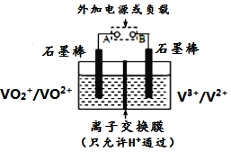
A. 放电时,右槽电解液pH不变
B. 充电时,阴极电解液pH升高
C. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
D. 充电时,每转移1mol电子,右槽中n(H+)的变化量为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)与足量的氢氧化钠溶液反应生成的盐只有NaH2PO2一种。等浓度的次磷酸(H3PO2)溶液与盐酸,前者导电能力弱。下列说法错误的是( )
A.H3PO2中,P元素的化合价为+1价
B.H3PO2为一元弱酸,NaH2PO2溶液呈碱性。
C.次磷酸在水中的电离方程式为H3PO2+H2O![]() H2PO2—+ H3O+
H2PO2—+ H3O+
D.NaH2PO2属于酸式盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某课外兴趣小组对X进行如下实验探究:

下列说法正确的是( )
A. 12.8g固体可能为Fe2O3 B. 混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
C. Fe2O3、Cu的物质的量之比为1:1 D. m>24.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,烧杯中盛有等体积的水和煤油,现将一小块金属钠加入烧杯中,试推断能观察到的实验现象应是( )

A. 钠悬浮在煤油层中
B. 钠静止在两液面之间
C. 钠沉入水底下
D. 钠在两液体界面附近上下跳动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为Na3AlF6 ,其中含有_______________________________等化学键。
(2)生成物中含有10个电子的分子是________(写分子式),该分子的空间构型_______,中心原子的杂化方式为___________________。
(3)反应物中所含元素电负性最大的元素为________(填元素符号),写出其原子最外层的电子排布图:_______________,它的氢化物的沸点比同主族其它氢化物的沸点高,原因是:_______________________________。
(4)冰晶石由两种微粒构成,它的晶胞结构如图甲所示,小黑点“●”位于大立方体的顶点和面心,小圆圈“○”位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处小三角“”所代表的是__________(填“小黑点”或“小圆圈”),它代表的是______________(填微粒化学式)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
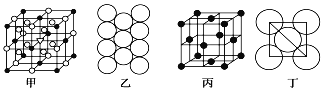
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________个; Al晶体的密度为__________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类文明的物质基础和先导,是直接推动社会发展的动力。
①现有下列材料:①钢化玻璃、②玻璃钢、③有机玻璃、④石英玻璃,其中与普通玻璃成分相同的是_______(填序号,下同),属于塑料的是______,属于复合材料的是_______,与光导纤维主要成分相同的是_______;生产普通玻璃的原料为__________(写化学式)。
②氧气和四氯化硅蒸气在旋转的高温炉中反应(发生置换反应),其产物之一可制得光导纤维,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是__________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是__________,生成水最多的是__________。
(4)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com