
【题目】25 ℃和101 kPa,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72 mL,原混合烃中乙炔的体积分数为( )
A. 15%B. 25%C. 45%D. 75%
【答案】B
【解析】
根据有机物燃烧的化学反应方程式,分析反应前后气体体积的变化,利用气体体积缩小了72mL及混合气体的体积列式计算出乙炔的体积,最后计算乙炔的体积分数。
常温下,水为液体,由乙烷、乙炔和丙烯燃烧的方程式可知,除去水蒸气,恢复到原来的温度和压强,
C2H6+![]() O2
O2![]() 2CO2+3H2O △V
2CO2+3H2O △V
1 ![]() 2 2.5
2 2.5
C2H2+![]() O2
O2![]() 2CO2+H2O △V
2CO2+H2O △V
1 ![]() 2 1.5
2 1.5
C3H6+![]() O2
O2![]() 3CO2+3H2O △V
3CO2+3H2O △V
1 ![]() 3 2.5
3 2.5
则C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质即可,设C2H6和C3H6一共为xmL,C2H2为ymL,则有x+y=32,2.5x+1.5y=72,解得y=8mL,混合烃中乙炔的体积分数为![]() ×100%=25%,故选B。
×100%=25%,故选B。


科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学在实验室用如下装置制取乙酸乙酯。其主要步骤如下:
①在30mL的大试管A中按体积比2:3:2的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min。
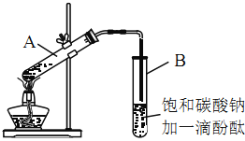
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
已知下列数据:
物质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙醇 | -117.0 | 78.0 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | ―― | 338.0 | 1.84 |
请回答下列问题:
(1)配制该混合溶液时,加入这三种物质的先后顺序是___________;写出制取乙酸乙酯的化学方程式:___________。
(2)该实验中,浓硫酸的作用是___________。
(3)上述实验中饱和碳酸钠溶液的作用是___________(填字母)。
A 吸收部分乙醇
B 中和乙酸
C 降低乙酸乙酯的溶解度,有利于分层析出
D 加速酯的生成,提高其产率
(4)步骤②中需要小火均匀加热操作,其主要理由是___________。
(5)步骤③中B试管内的上层物质是___________(填物质名称)。
(6)步骤④中分离操作用到的主要仪器是___________;可选用的干燥剂为___________(填字母)。
A 生石灰 B NaOH固体
C 碱石灰 D 无水Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水污染的防治、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醚:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
CH3OCH3(g)+3H2O(g) ΔH ,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
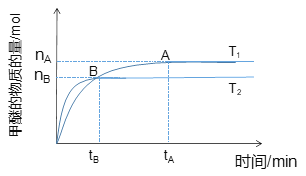
(1)在容积为2 L密闭容器中合成甲醇;其他条件不变的情况下,考察温度对反应的影响,如图所示
①该反应的ΔH________0;ΔS______0(填“>”、“<”或“=”)。
②下列措施可增加甲醚产率的是_____________。
A.升高温度 B.将CH3OCH3(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
③温度为T1时,从反应开始到平衡,生成甲醚的平均速率为___________________。
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2合成甲醚
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”)。
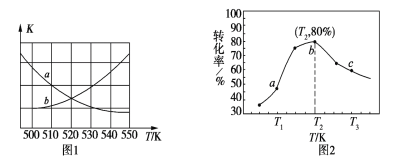
②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A为原料,经过以下途径可以合成一种重要的制药原料有机物F。
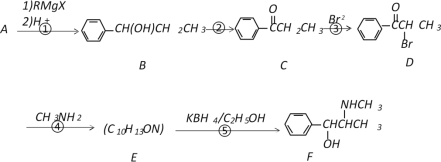
已知:
I.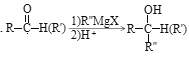
II.A蒸气的密度是相同条件下氢气密度的53倍。
请回答下列问题:
(1)写出A的结构简式_____________;E中含氧官能团的名称为__________________。
(2)D→E的反应类型是_____________,E→F的反应类型是_________________。
(3)写出反应④的化学反应方程式___________________________________________。
(4)符合下列条件的C的同分异构体有________种(不考虑顺反异构)。
a.苯环上有两个取代基 b.能与NaOH溶液反应 c.分子中含有两种官能团
(5)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同的是(_______)(填字母序号)
A.核磁共振仪 B.元素分析仪 C.质谱仪 D.红外光谱仪
(6)以A为原料可以合成高分子化合物G(  ),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
),请设计出合理的合成路线(无机试剂任选)。________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是 ( )
A. 标准状况下,22.4 L二氯甲烷的分子数约为NA个
B. 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
D. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究酸化条件对0.1mol/LKI溶液氧化反应的影响。
序号 | 操作及现象 |
实验1 | 取放置一段时间后依然无色的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液立即变蓝 |
实验2 | 取新制的0.1mol/LKI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6mol/L的稀硫酸,溶液10s后微弱变蓝 |
(1)溶液变蓝,说明溶液中含有____________ 。结合实验1和实验2,该小组同学认为酸化能够加快I-氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1mol/LKI溶液成分与新制0.1mol/LKI溶液可能存在差异,并继续进行探究。
实验3:取新制0.1mol/LKI溶液在空气中放置,测得pH如下:
时间 | 5分钟 | 1天 | 3天 | 10天 |
pH | 7.2 | 7.4 | 7.8 | 8.7 |
资料:
ⅰ.pH<11.7时,I-能被O2氧化为I。
ⅱ.一定碱性条件下,I2容易发生歧化,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用化学用语,解释0.1mol/LKI溶液放置初期pH升高的原因:_________________________________________________________。
②对比实验1和实验2,结合化学用语和必要的文字,分析实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是_____________________________________________________________________________________。
(3)同学甲进一步设计实验验证分析的合理性。
序号 | 操作 | 现象 |
实验4 | 重复实验2操作后,继续向溶液中加入 ________________。 | 溶液立即变蓝 |
(4)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL 4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
实验组 | A | B | C | D |
pH | 11.4 | 10.6 | 9.5 | 8.4 |
现象 | 无颜色变化 | 产生蓝色后瞬间消失 | 产生蓝色,30s后蓝色消失 | |
从实验5可以看出pH越大,歧化反应速率越_______________(填“快”或“慢”)。
解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在科研与生活中有重要作用,某兴趣小组用0.50molL-1 KI、0.2%淀粉溶液、0.20molL-1 K2S2O8、0.10molL-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= mL,理由是 。
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注)。
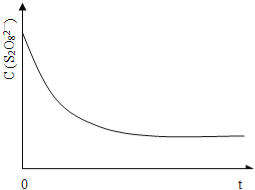
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡HIn(aq,红色) ![]() H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
H+(aq)+ In-(aq,黄色)故可作酸碱指示剂。浓度为0.02mol/L的下列溶液:① 盐酸 ② 石灰水 ③ NaCl溶液 ④ NaHSO4溶液 ⑤ NaHCO3溶液 ⑥ 氨水,其中能使指示剂显红色的是
A. ④⑤B. ③⑤C. ①④D. ②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫通入氯化钡溶液中理论上不产生沉淀,而实际受到空气和溶液中氧气的影响很快便能观察到沉淀现象。为了避免产生沉淀,某化学小组设计了如下实验装置,实验操作步骤如下:
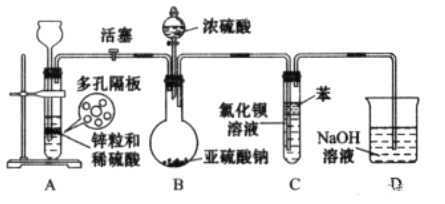
①气密性检査完好后,在装置A中的多孔隔板上放上锌粒,通过_______注入稀硫酸、打开活塞,将产生的氢气导入到后续装置。
②________后,关闭活塞,将装置D的导管插入烧杯中。
③通过装置B的________滴加浓硫酸,产生的气体进入到BaCl2溶液中,溶液保持澄清。
④打开活塞,将产生的氢气导入后续装置一段时间。
⑤将盛有BaCl2溶液的试管从装置中取出,拔去橡皮塞用胶头滴管伸入到苯层下方滴加双氧水,随即出现白色浑浊,滴加稀盐酸并振荡,白色浑浊不消失。
⑥拆卸装置,清洗仪器,处理剩余药品。
请回答下列问题:
(1)实验步骤①和③的空白处使用的仪器分别为__________、__________
(2)装置C中苯的作用是__________。
(3)实验步骤②的操作为__________。
(4)实验步骤④的目的是__________。
(5)写出实验步骤⑤试管中发生反应的化学方程式:__________、____________。
(6)为了避免产生沉淀,你认为还应采取哪些措施?请举一例:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com