
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
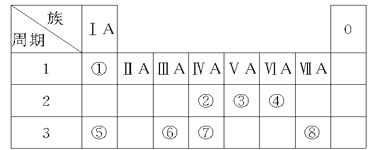
(1)④、⑤、⑥的原子半径由大到小的顺序为(填元素符号)_______。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物,写出该化合物的电子式________。
(4)②的氧化物的结构式_________;比较②、⑦的氧化物的熔点(填化学式):
______>_______,原因是___________________________________________。
(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。
①Be(OH)2与Mg(OH)2可用__________鉴别(填名称)。
②写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:_________________________。
【答案】 Na>Al>O HNO3>H2CO3>H2SiO3(或H4SiO4) ![]() O=C=O SiO2 CO2 二氧化碳形成分子晶体,二氧化硅是原子晶体 氢氧化钠溶液 Be+2OH-===BeO
O=C=O SiO2 CO2 二氧化碳形成分子晶体,二氧化硅是原子晶体 氢氧化钠溶液 Be+2OH-===BeO![]() +H2↑
+H2↑
【解析】参照元素①~⑧在表中的位置可知分别是H、C、N、O、Na、Al、Si、Cl。则
(1)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则④、⑤、⑥的原子半径由大到小的顺序为 Na>Al>O。(2)非金属性是N>C>Si,非金属性越强,最高价含氧酸的酸性越强,则②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4)。(3)①、④、⑤三种元素可形成既含离子键又含共价键的化合物是氢氧化钠,电子式为![]() 。(4)②的氧化物是CO2,结构式为 O=C=O;二氧化碳形成分子晶体,二氧化硅是原子晶体,属于CO2的熔点低于二氧化硅。(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。①Be(OH)2是两性氢氧化物,因此与Mg(OH)2可用氢氧化钠溶液鉴别。②Be与NaOH溶液反应生成Na2BeO2的离子方程式为Be+2OH-=BeO22-+H2↑。
。(4)②的氧化物是CO2,结构式为 O=C=O;二氧化碳形成分子晶体,二氧化硅是原子晶体,属于CO2的熔点低于二氧化硅。(5)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。①Be(OH)2是两性氢氧化物,因此与Mg(OH)2可用氢氧化钠溶液鉴别。②Be与NaOH溶液反应生成Na2BeO2的离子方程式为Be+2OH-=BeO22-+H2↑。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中10种元素用元素符号或化学式填空回答以下问题:

Ⅰ.填写下列空白:
(1)非金属性最强的元素是___________(填元素符号),
(2)写出①与③形成原子个数比为1:1化合物的电子式:____________,该化合物酸性条件下与高锰酸钾反应的离子方程式:__________________________
(3)最高价氧化物对应的水化物中碱性最强的是_______(填化学式),写出该物质与⑦的最高价氧化物对应的水化物反应的离子方程式为:____________。
(4)由①②③⑩四种元素中的三种组成的一种强酸,该强酸的稀溶液与铜反应的离子方程式 ____________________________
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂,X是一种氢化物,常温下为液体。则:

(1)A与液体X反应的化学方程式:____________________________;
(2)气体Y是一种大气污染物,无色、有刺激性气味的气体,直接排放会形成酸雨。写出气体Y与氯水反应的离子方程式:___________________________;
(3)在100 mL 18 mol/L的F浓溶液中加入过量铜片,加热使之充分反应,产生气体的体积为11.2 L(标况下),则反应过程中转移的电子数为__________(用“NA”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
物 质 | 试 剂 | |
A | Na2SO4溶液(NaBr) | Cl2 |
B | KNO3(NaCl) | AgNO3溶液 |
C | Cl2(HCl) | 饱和食盐水 |
D | CO2(HCl) | 饱和Na2CO3溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A(g)+B(g)==C(g)+2D(g)反应中,下列表示的反应速率最快的是
A. v(A)=0.1mol L-1 min-1 B. v(B)= 0.2mol L-1 min-1
C. v(C)= 0.3mol L-1 min-1 D. v(D)= 0.4mol L-1 min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能检验出一定存在的离子是( )
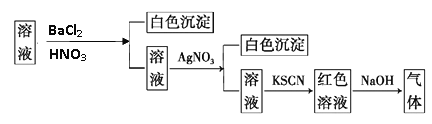
A. SO42-、NH4+ B. Cl- C. Fe3+ D. NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.增大反应物浓度可增大活化分子百分数,所以反应速率增大
B.放热反应的反应速率一定大于吸热反应的反应速率
C.反应NH3(g) + HCl(g)![]() NH4Cl(s)在室温下可自发进行,则该反应的△H<0
NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.对于反应X(s)+aY(g)![]() bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com