
分析 (1)分别计算出两溶液中含有溶质的质量,然后根据质量分数的公式计算;
(2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度.
解答 解:(1)20.0g质量分数为15.0%的KNO3溶液中溶质的质量为:20.0g×15.0%=3.0g,
40.0g质量分数为30.0%的KNO3溶液中含有溶质的质量为:40.0g×30.0.0%=12.0g,
溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为:$\frac{3.0g+12.0g}{20.0g+40.0g}$×100%=25%.
答:混合后溶液的质量分数为25%;
(2)混合液中溶质的质量为:3.0g+12.0g=15.0g,溶质的物质的量为:n=$\frac{15.0g}{101g/mol}$=$\frac{15}{101}$mol,
溶液的体积为V=$\frac{40g+20g}{1.2g/mL}$=500mL=0.5L,
所以溶液的物质的量浓度为:c=$\frac{\frac{15}{101}mol}{0.5L}$≈2.97mol/L,
答:混合后溶液的物质的量浓度为2.97 mol/L.
点评 本题考查了物质的量浓度、溶质的质量分数的计算,题目难度中等,注意物质的量浓度、溶质的质量分数计算方法,该题是高考中的常见考点和题型,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
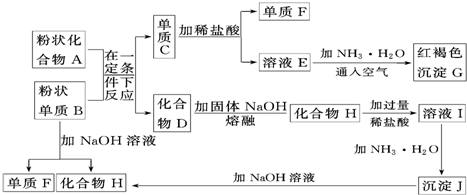
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(SO2)=4 mol/(L•min) | B. | v(O2)=2 mol/(L•min) | ||
| C. | v(SO2)=0.1 mol/(L•min) | D. | v(SO2)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火可用水扑灭 | |
| B. | 钠可从硫酸镁溶液中置换出大量的镁 | |
| C. | 自然界可存在少量的钠单质 | |
| D. | 金属钠长期置于空气中,最终变成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
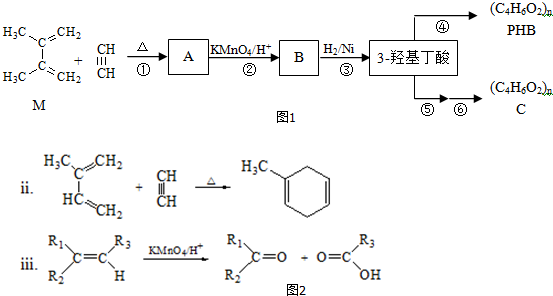
 .
. ;
;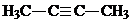 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com