
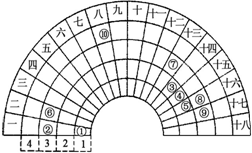
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、②、⑧、⑨对应简单离子半径依次减小 |
| B、⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C、元素⑩处于常见周期表第四周期第VIIIB族 |
| D、①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、NiO(OH) |
| B、Ni(OH)2 |
| C、H2 |
| D、H2和NiO(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
238 92 |
235 92 |
238 92 |
238 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素原子的核外电子排布呈周期性变化 |
| B、元素的原子半径呈周期性变化 |
| C、元素的化合价呈周期性变化 |
| D、元素的金属性、非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中一定含离子键,也可能有共价键 |
| B、所有非金属之间形成的化学键一定是共价键 |
| C、电子数相同的两种微粒一定是同一元素 |
| D、共价化合物中一定无离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫原子的原子结构示意图: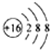 | ||
B、NH4Cl的电子式: | ||
C、原子核内有18个中子的氯原子:
| ||
D、NH3 的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3?H2O电离达到平衡的标志是溶液呈电中性 | ||
B、
| ||
| C、氨水促进了水的电离 | ||
D、c(NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:

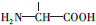 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com