
【题目】工业上常用如下的方法从海水中提碘:
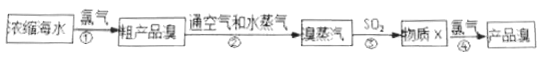
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_________;
氯气分子中所含的化学键名称是:_________;在![]() 原子钟,其核外存在_________种运动状态不同的电子。
原子钟,其核外存在_________种运动状态不同的电子。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:_________,
两者气态氢化物的稳定性是:_________>_________(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______________(文字简述)。
(4)写出步骤③中反应的化学方程式(说明:此反应在水溶液中进行):________________;在该反应中被氧化的元素是:_________。
(5)工业上利用海水还有一个重要的反应就是电解饱和食盐水,此反应中的阴极产物是:_________和_________(写化学式)。
(6)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为溴化钠、溴酸钠,同时放出二氧化碳,请写出该反应的化学方程式并标明电子转移方向与数目:______________________。
【答案】 第三周期第ⅦA族 共价键 17 ![]() HF HCl 沸点低,易挥发 Br2+SO2+2H2O→H2SO4+2HBr S H2 NaOH
HF HCl 沸点低,易挥发 Br2+SO2+2H2O→H2SO4+2HBr S H2 NaOH ![]()
【解析】(1)氯元素核电荷数17,原子核外三个电子层,最外层电子数7个,位于周期表中第三周期第ⅤⅡA,氯气分子中氯原子间相处一对共用电子对,形成一个共价键,氯原子核外17个电子,其核外存在17种运动状态不同的电子,故答案为:第三周期第ⅤⅡA;共价键;17;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,电子式为,![]() ,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,故答案为:
,非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl,故答案为:![]() ;HF;HCl;
;HF;HCl;
(3)步骤②中用空气和水蒸气将溴吹出,并用SO2氧化吸收,从而达到富集溴,体现了溴具有的性质是沸点低,易挥发,故答案为:沸点低,易挥发;
(4)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,反应中被氧化的元素是S元素,化合价+4价变化为+6价,故答案为:Br2+SO2+2H2O=H2SO4+2HBr;S;
(5)电解饱和食盐水溶液中氯离子在阳极失电子被氧化生成氯气,氢离子在阴极得到电子生成氢气被还原,水电离平衡正向进行,溶液中氢氧根离子浓度增大溶液中生成氢氧化钠,故答案为:H2;NaOH;
(6)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的化学方程式为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,溴元素0价变化为-1价和+5价,电子转移总数5e-,该反应的化学方程式并标明电子转移方向与数目为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】Ⅰ.下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积2mol/L的硫酸于试管中 ② | Mg产生气泡速率快于Fe,Cu无明显变化 | 金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是探究 。
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个微粒一定不属于同种元素原子的是
A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应所对应的离子方程式书写正确的是
A. 醋酸铵与稀盐酸反应:CH3COONH4+H+→CH3COOH+![]()
B. 氯化铁溶液中通入硫化氢气体:2Fe3++S2-→2Fe2++S↓
C. 硫酸铜溶液中加入过量的氢氧化钡:Ba2++![]() →BaSO4↓
→BaSO4↓
D. 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜根据在相同的温度下NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小的性质,运用CO2+NH3+H2O+NaCl→NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
![]()
则下列叙述不正确的是
A. A气体是CO2,B气体是NH3
B. 第Ⅲ步得到的晶体是发酵粉的主要成分
C. 第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D. 第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁和氧化铜混合物mg,加3mol·L-1盐酸溶液100mL,恰好完全溶解,若mg的该混合物在过量氢气流中加热充分反应,冷却后剩余固体质量为( )
A.(m-2.4)g B.(m-1.6) g C.(m-3.2)g D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.仅用酸性高锰酸钾溶液可区分苯和甲苯
B.仅用氯化铁溶液可区分苯酚稀溶液和甘油
C.仅用硝酸和硝酸银溶液可验证卤代烃中卤原子的种类
D.仅用溴的四氯化碳溶液可区别液态的植物油和动物油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com