
【题目】下列说法错误的是( )
A.液氨可用作制冷剂B.SO2使湿润的蓝色石蕊试纸变红
C.常温下可以用铁或铝制容器盛装浓硝酸或浓硫酸D.测定某雨水的pH值小于7.0可判断雨水为酸雨
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假假设1: 该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3: K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是___________________________________________
【设计、完成实验】
(1)称取_______g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和___________________________。
②下列操作会使所配溶液浓度偏低的是_______(填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘
B.定容时俯视刻度线
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
(2)完成探究,记录数据
实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
则x =________________,假设___________成立
(3)由于KMnO4能氧化水中有机物等因素,配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定并记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,
判断滴定终点的现象为_____________________________。上述实验中KMnO4溶液的物质的量浓度为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)铜元素位于元素周期表中的___区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是_______。
②在[Cu(NH3)4]SO4中,配离子所含有的化学键为________,提供孤电子对的成键原子是_______。
③ 除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为_______。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_____。但NF3不易与Cu2+形成化学键,其原因是____________。
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____ g/cm3(不必化简,用NA表示阿伏加德罗常数)。
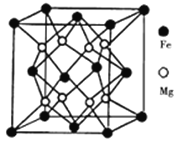
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
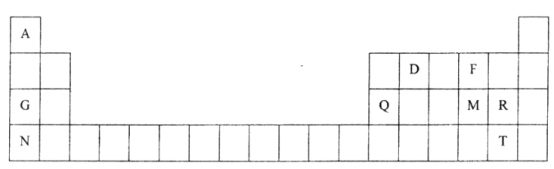
(1)以上9种元素中金属性最强的元素是_______(填元素符号)。
(2)元素的非金属性:M______R(填“>”或“<”)。
(3)R的最高价氧化物对应水化物的化学式是_____________。
(4)F、G两元素形成的淡黄色固体物质的电子式为_____________。
(5)表中M、R、N元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是_____________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 蒸发NaAlO2溶液可以获得固体NaAlO2 | NaAlO2在水中不会水解 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中,所得溶液的密度为ρ g·mL-1,质量分数为ω,物质浓度为c mol·L1,则下列关系中正确的是( )
A. c=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D. ρ=
D. ρ=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L1molL﹣1NaOH溶液吸收0.6molCO2 , 所得溶液中Na2CO3和NaHCO3的物质的量之比约为( )
A.2:3
B.1:2
C.2:1
D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究。反应原理为:Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为________________。(填接头序号)
(2)D中盛装的试剂为_________________。
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的_____________,可观察到的现象_________ 。
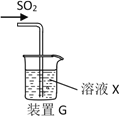
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L ____和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入_______ 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(C8H8)外观为有光泽的晶体。其八个碳原子对称地排列在立方体的八个角上。以下相关说法错误的是
A. 立方烷在空气中可燃,燃烧有黑烟产生
B. 立方烷一氧代物1种、二氯代物有3种、三氯代物也有3种
C. 立方烷是苯(C6H6)的同系物、也是苯乙烯(C6H5-CH=CH2)的同分异构体
D. 八硝基立方烷完全分解可能只产生二氧化碳和氮气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com