
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 化学反应速率和化学平衡练习卷(解析版) 题型:填空题
已知反应①Fe(s)+CO2(g)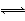 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g) CO2(g) ΔH=b kJ·mol-1;反应③Fe2O3(s)+3CO(g)
CO2(g) ΔH=b kJ·mol-1;反应③Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH=c kJ·mol-1。测得在不同温度下,K值如下:
2Fe(s)+3CO2(g) ΔH=c kJ·mol-1。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为 。
(2)反应①为 (选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积B.通入CO2C.温度升高到900 ℃D.使用合适的催化剂
E.增加Fe的量
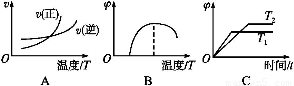
(4)下列图像符合反应①的是 (填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
(5)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)的ΔH= 。
2FeO(s)的ΔH= 。
(6)请运用盖斯定律写出Fe(固体)被O2(气体)氧化得到Fe2O3(固体)的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆州市毕业班质量检查(一)化学试卷(解析版) 题型:填空题
(1)已知:①Fe(s)+1/2O2(g)=FeO(s) △H1=-272.0KJ·mol-1
②2Al(s)+3/2(g)=Al2O3(s) △H2=-1675.7KJ·mol-1
Al和FeO发生铝热反应的热化学方程式是__ __。
某同学认为,铝热反应可用于工业炼铁,你的判断是_ (填“能”或“不能”),你的理由

(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A.B,如图所示。①据图判断该反应是 (填“吸”或“放” )热反应,当反应达到平衡后,其他条件不变,,升高温度,反应物的转化率将 (填“增大”、 “减小”或“不变”)。
②其中B历程表明此反应采用的条件为
(填字母)。
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:填空题
中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究 院对四川泸天化尿塔腐蚀过程进行研究,得出下列腐蚀机理:
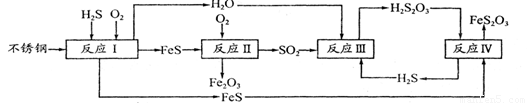
(1)H2S来自合成尿素的天然气。在380 K、体积为2 L的密闭容器中,存在如下反应:H2(g)+S(s)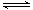 H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2 S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
H2S(g) △H=+21.6kJ·mol-1。反应达到平衡时H2、S、H2 S的物质的量均为3 mol,则380 K时该反应的化学平衡常数为______;下列对该反应分析正确的是______(填字母序号)。
(2)在反应I中发生的化学反应为______。
(3)研究发现反应II是分别以Fe、FeS为电极,以水膜为电解质溶液的电化学腐蚀,其 负
极为______;
已知:Fe(s)+S(s)=FeS(s) △H1=-2.5akJ·mol-1
S(s)+O2(g)=SO2(g) △H2=-5akJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-6akJ·mol-1
则反应II的热化学方程式为_____
(4)已知H2S2O3的K1=2.2×10-1、K2=2.8×10-2。Na2S2O3水溶液呈______性,该 溶液中电荷守恒式为_____ ;反应IY的反应类型为______ ;该反应______(填“能”或“不能”) 说明FeS溶解性强于FeS2O3
(5)泸天化尿塔的最终腐蚀产物为______;为了有效防腐,北钢建议泸天化在生产中用 CuSO4溶液“脱硫(H2S)”,其中涉及的离子方程式为
__________________
查看答案和解析>>
科目:高中化学 来源:2011-2012年江苏淮安市高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)已知化学反应①Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973 K 和1173 K 情况下,K1、K2的值分别如下:
|
温度 |
K1 |
K2 |
|
973 K |
1.47 |
2.38 |
|
1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。
(3)能判断反应③已达平衡状态的是________。
A.容器中压强不变 B.混合气体中c(CO)不变 C.v正(H2)=v逆(H2O)D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式__________________。据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com