
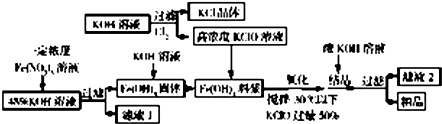
分析 (1)反应中KClO是氧化剂,氧化产物是K2FeO4,还原产物是KCl,还原剂是Fe(OH)3,根据得失电子守恒、电荷守恒、原子守恒配平书写;
(2)反应液本身显碱性,可见加入浓KOH溶液的目的不是增强高铁酸钾的稳定性,而是增大K+浓度,促进K2FeO4晶体析出;
(3)滤液2的溶质主要成分是KOH、KClO,循环利用是提高生产效益、减少废液排放的首选措施;
(4)因为K2FeO4在酸性或中性溶液中能分解,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤;
(5)加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4;
(6)反应中铁由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O.
解答 解:(1)反应中KClO是氧化剂,氧化产物是K2FeO4,还原产物是KCl,还原剂是Fe(OH)3,根据得失电子守恒可得:2Fe(OH)3+3ClO-→2FeO42-+3Cl-,根据电荷守恒可得2Fe(OH)3+3ClO-+4OH-→2FeO42-+3Cl-,最后根据原子守恒可得:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(2)反应液本身显碱性,可见加入浓KOH溶液的目的不是增强高铁酸钾的稳定性,而是增大K+浓度,促进K2FeO4晶体析出,
故答案为:增大K+的浓度,促进K2FeO4晶体析出;
(3)滤液2的溶质主要成分是KOH、KClO,向滤液2中通入氯气,制取高浓度的KClO溶液,进行循环利用,
故答案为:向滤液2中通入氯气,制取高浓度的KClO溶液;
(4)因为K2FeO4在酸性或中性溶液中能分解,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤,最后用异丙醇洗涤,真空干燥,
故答案为:加入饱和KOH溶液、冷却结晶、过滤;
(5)加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为:Na2FeO4+2KOH=K2FeO4+2NaOH,
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH;
(6)反应中铁由+2价升高到+6价,过氧化钠中的部分氧由-1价升高到0价,根据氧化还原反应中元素化合价升降规律,过氧化钠中的另一部分氧一定会由-1价降低到-2价,反应中硫、铁原子已经守恒,故X只能为Na2O,配平后方程式为:2FeSO4+6Na2O2 $\frac{\underline{\;高温\;}}{\;}$2Na2FeO4+2Na2O+2Na2SO4+O2↑,故a=6,
故答案为:Na2O;6.
点评 本题主要考查化学工艺流程分析,意在考查考生对已学知识的掌握、理解、迁移、转化、重组和解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | c(N2):c(H2):c(NH3)=1:3:2 | |
| B. | N2、H2和NH3的质量分数不再改变 | |
| C. | N2与H2的物质的量之和是NH3的物质的量的2倍 | |
| D. | 单位时间里每增加1 mol N2,同时减少2 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠和石蕊试剂 | B. | Na2CO3溶液和石蕊试剂 | ||
| C. | 酸性KMnO4和溴水 | D. | NaOH溶液和CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯酸和油酸互为同系物 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | CuSO4浓溶液能使蛋白质溶液发生盐析 | |
| D. | 麦芽糖和脂肪在一定条件下都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
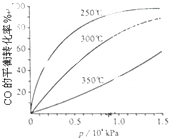 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com