
写出以CH2ClCH2CH2CH2OH为原料制备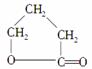 的各步反应方程式(必要的无机试剂自选)。
的各步反应方程式(必要的无机试剂自选)。
①________________________________________________________________________
________________________________________________________________________;
②________________________________________________________________________
________________________________________________________________________;
③________________________________________________________________________
________________________________________________________________________;
④________________________________________________________________________。
科目:高中化学 来源: 题型:
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,其中由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
煤是一种重要的能源,含有硫元素,燃烧时会生成SO2。下列说法正确的是
( )。
A.煤是含硫化合物
B.煤是一种可再生能源
C.在水吸收SO2的过程中只发生物理变化
D.SO2是酸性氧化物,被云雾吸收后可转化成酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
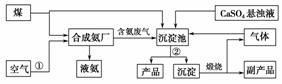
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色、高效”概括了2005年诺贝尔化学奖的特点。换位合成法在化学工业中每天都在应用,主要用于研制新型药物和合成先进的塑料材料。在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应⑥消去反应 ⑦加聚反应 ⑧缩聚反应等反应类型中能体现这一原子最经济原则的是( )
A.①②⑤ B.②⑤⑦ C.⑦⑧ D.⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生 素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如下:
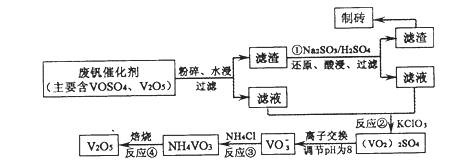
请回答下列问题。
(1)工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式: 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。X为 (写化学式)。
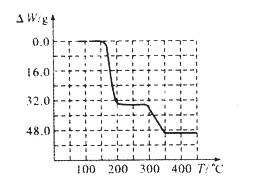
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化 的曲线如上图所示。则NH4VO3在分解过程中 (填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列实验设计及其对应的离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com