
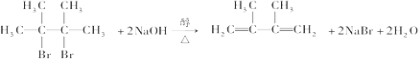 ;
; ;E与乙二醇的关系是同系物.
;E与乙二醇的关系是同系物.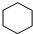 .
. 分析 某烃A的相对分子质量为84,则烃中C原子最大数目=$\frac{84}{12}$=7,故有机物分子式为C6H12.
(1)将烃及烃的含氧衍生物通式可知CxHyOz,若总物质的量一定,若各组分耗氧量(x+$\frac{y}{4}$-$\frac{z}{2}$)相等,则消耗氧气的量相等,否则不相等;
(2)①烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则结构对称,只含一种H;
②B与NaOH的醇溶液共热可得到D,为消去反应;
③B与足量NaOH水溶液完全反应,生成有机物E,为水解反应,E与乙二醇中均含2个-OH,但C原子数目不同;
(3)核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A为CH2=C(CH2CH3)CH2CH3;
(4)A不能使溴水褪色,且其一氯代物只有一种,则不含C=C,只有一种H,应为环烃.
解答 解:某烃A的相对分子质量为84,则烃中C原子最大数目=$\frac{84}{12}$=7,故有机物分子式为C6H12.
(1)1molC6H12的耗氧量=(6+3)mol=9mol,将烃及烃的含氧衍生物通式可知CxHyOz,若总物质的量一定,若各组分耗氧量(x+$\frac{y}{4}$-$\frac{z}{2}$相等,则消耗氧气的量相等,否则不相等;
a.1molC7H12O2 的耗氧量=(7+3-1)mol=9mol,
b.C6H14 的耗氧量=(6+$\frac{14}{4}$)mol=9.5mol,
c.C6H14O 的耗氧量=(6+$\frac{14}{4}$-$\frac{1}{2}$)mol=9mol,
d.C7H14O3 的耗氧量=(7+$\frac{14}{4}$-$\frac{3}{2}$)mol=9mol,
故等物质的量的C6H12与C6H14的耗氧量不相等,
故答案为:b;
(2)①烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种,则结构对称,只含一种H,即含4个甲基,A为(CH3)2C=C(CH3)2;
故答案为:(CH3)2C=C(CH3)2;
②B与NaOH的醇溶液共热可得到D,为消去反应,该反应为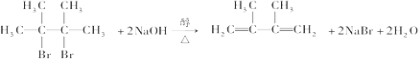 ,
,
故答案为: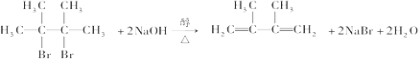 ;
;
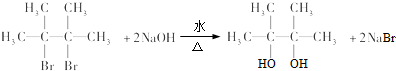
③B与足量NaOH水溶液完全反应,生成有机物E,为水解反应,该反应为 ,E与乙二醇中均含2个-OH,但C原子数目不同,结构相似,则二者互为同系物,
,E与乙二醇中均含2个-OH,但C原子数目不同,结构相似,则二者互为同系物,
故答案为: ;同系物;
;同系物;
(3)核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A为CH2=C(CH2CH3)CH2CH3,
或CH3CH2CH=CHCH2CH3,名称分别为2-乙基-1-丁烯、3-己烯,
故答案为:2-乙基-1-丁烯或3-己烯;
(4)A不能使溴水褪色,且其一氯代物只有一种,则不含C=C,只有一种H,应为环烃,其结构简式为 ;
;
故答案为: .
.
点评 本题考查有机物的推断,明确相对分子质量推出A为烯烃或环烷烃是解答的突破口,注意利用有机物结构与性质的关系来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间 | |
| B. | 化学反应达到最大限度时,正逆反应速率也达到最大且相等 | |
| C. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 | |
| D. | 用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 钢钉表面有白色沉淀 | B. | 实验2中的高锰酸钾溶液先变色 | ||
| C. | 负极的电极反应为:Fe-3e-→Fe3+ | D. | 铁钉表面有红褐色物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
, ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(甲):c(乙)=1:10 | B. | c(H+)甲:c(H+)乙=1:2 | ||
| C. | c(OH-)甲:c(OH-)乙=10:1 | D. | a(甲):a(乙)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠水解的平衡常数Kh随温度升高而减小 | |
| B. | 0.5mol•L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol•L-1醋酸钠溶液pH为n,水解的程度为b,则m<n、a>b | |
| C. | 醋酸钠的水解的平衡常数Kh=KW•Ka | |
| D. | 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol•L-1,向其中加入固体醋酸钠,使其浓度为0.9mol•L-1,以上三种金属离子中只有Zn2+能生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分.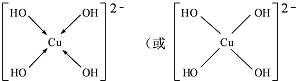 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com