
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
分析 A、光导纤维的主要材料为二氧化硅;
B、把游离态的氮转化为氮的化合物是氮的固定;
C、重金属铬能与蛋白质发生作用,使其丧失生理活性,对人体造成危害;
D、高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌于一体的新型多功能水处理剂.
解答 解:A、光导纤维的主要材料为二氧化硅,可与氢氧化钠反应,而硅常用于半导体材料,故A错误;
B、把游离态的氮转化为氮的化合物是氮的固定,工业上用氢气和氮气合成氨是氮的固定,植物也能固氮,故B错误;
C、重金属铬能与蛋白质发生作用,使其丧失生理活性,对人体造成危害,故C错误;
D、高铁酸钾(K2FeO4)中铁为+6价,有强氧化性,故能杀菌消毒,其还原产物为Fe3+,能水解为Fe(OH)3,又能净水,故D正确.
故选D.
点评 本题考查化学与生产、生活相关的知识,比较基础,是高考考查的热点之一,但涉及知识点较多,灵活运用所学知识进行解答.


科目:高中化学 来源: 题型:解答题
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,CO2
,CO2 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>D>C | B. | B>D>A>C | C. | D>A>B>C | D. | D>B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
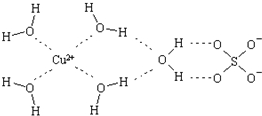 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com