
(7分)如图所示,试回答下列问题 (灯泡功率合适):
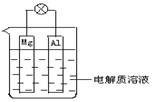
(1)该装置是 (填“原电池”或“电解池”.)
(2)电解质溶液为稀H2SO4时,灯泡
(填“亮”或“不亮”,填 “亮”做a题,
填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应 为:
Al电极上发生的反应为:
b.若灯泡不亮,其理由为:
(3)电解质溶液为NaOH(aq)时,灯泡
(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极为: 极;Al电极为: 极(填“正”“负”)
b.若灯泡不亮,其理由为: .
科目:高中化学 来源: 题型:
 (1)原NaOH溶液的物质的量浓度为
(1)原NaOH溶液的物质的量浓度为查看答案和解析>>
科目:高中化学 来源: 题型:
 气体,E气体可用固态的D干燥,①、②是工业生产中的重要反应,它们的部分关系如图所示:
气体,E气体可用固态的D干燥,①、②是工业生产中的重要反应,它们的部分关系如图所示:
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2011?静安区模拟)已知溶液中:还原性HSO3>I-,氧化性IO
(2011?静安区模拟)已知溶液中:还原性HSO3>I-,氧化性IO- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com