
分析 (1)①碘不易溶于水,易溶于有机溶剂;
②食盐水中水易挥发;
③海水中水的沸点低;
④碱式碳酸铜加热生成CuO、水和二氧化碳;
(2)①根据KNO3固体和NaNO3的溶解度随温度的变化趋势来确定提纯方法;
②根据除杂时注意不能引入新的杂质和除杂所加的试剂是过量的.
解答 解:(1)①碘不易溶于水,易溶于有机溶剂,则选择萃取法分离出碘水中的碘,
故答案为:萃取;
②食盐水中水易挥发,则除去食盐溶液中的水,可采用蒸发的方法,
故答案为:蒸发;
③海水中水的沸点低,若淡化海水,可采用蒸馏的方法,
故答案为:蒸馏;
④碱式碳酸铜加热生成CuO、水和二氧化碳,则利用加热分解法除杂,
故答案为:加热分解;
(2)①KNO3固体的溶解度随温度的升高明显增大,NaNO3固体的溶解度受温度变化影响较小,如提纯硝酸钾,就要让硝酸钾成为晶体析出,所以用降温结晶的方法,步骤是:溶解、加热蒸发、冷却、结晶、过滤,
故答案为:溶解;过滤;
②除去KCl溶液中的SO42-,应先加入过量BaCl2的使SO42-生成沉淀,然后加入K2CO3使过量的BaCl2生成沉淀,过滤后加入HCl除去过量的K2CO3,
故答案为:BaCl2、K2CO3、HCl.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 根据实验现象可以判断电解时阳极的电极反应式为:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
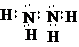 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图所示装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于20% | B. | 大于20% | C. | 小于20% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2•t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.7 | 6.7 |
| 2 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeSO4溶液中先滴入KSCN 溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| B | 常温下将铜片放入浓硫酸中 | 生成刺激性气味的气体 | 反应生成了SO2 |
| C | 室温下,向浓度均为0.1mol•L-1的BaC12和CaCl2混合溶液中滴加Na2SO4溶液 | 出现白色沉淀 | Ksp(BaSO4)<Ksp(CaSO4) |
| D | 向Ba(NO3)2溶液中通入SO2气体 | 有白色沉淀生成 | 沉淀是BaSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com