
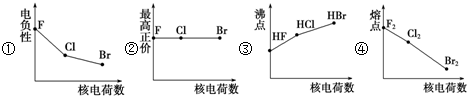
| A. | ①②③④ | B. | ②③④ | C. | ① | D. | ①②③ |
分析 ①非金属性越强,电负性越大;
②F电负性最强,没有最高正化合价;
③HF中存在氢键,导致HF的沸点大于硫化氢、溴化氢;
④卤素单质中,原子序数越大,沸点越高.
解答 解:①F、Cl、Br的非金属性逐渐减小,其电负性逐渐减弱,故①正确;
②F元素没有正化合价,曲线的变化趋势与实际不相符,故②错误;
③HF分子中含有氢键,其分子间作用力大大增加,则HF的沸点大于HCl、HBr,曲线的变化趋势与实际不相符,故③错误;
④随着原子序数的递增,卤素单质的沸点逐渐升高,图象曲线变化与实际不相符,故④错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用、电负性强弱判断,题目难度中等,明确元素周期律内容为解答关键,注意掌握电负性强弱的影响因素,试题侧重考查学生的分析能力及灵活应用能力.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SO3+H2O→H2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | 2 F2+2 H2O→4 HF+O2 | D. | 2 Al+6 H2O$\stackrel{△}{→}$2 Al(OH)3+3 H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 小明设计的探究燃烧条件的实验如图所示.请回答下列问题.
小明设计的探究燃烧条件的实验如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol KClO3 | B. | 1mol KCl | C. | 1mol Ca(ClO)2 | D. | 2mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
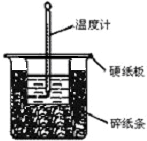 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
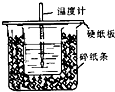 中和热的测量,是一个重要的定量实验.
中和热的测量,是一个重要的定量实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.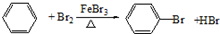 ,反应类型:取代反应.
,反应类型:取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向澄清石灰水中加入盐酸 Ca(OH)2+2H+→Ca2++2H2O | |
| B. | 硫化亚铁与盐酸反应 S2-+2H+→H2S↑ | |
| C. | 氯化铝溶液与过量氨水反应 Al3++3NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入少量氯气 Fe2++Cl2→Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com