
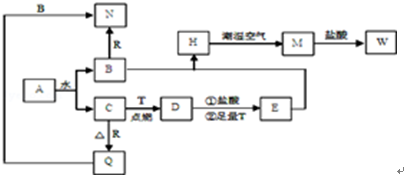


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处理废水时加入明矾作为消毒剂可以除去水中的杂质 |
| B、利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
| C、高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
| D、PM2.5含有的铅、镉、铬、钒、砷等元素均为对人体有害的金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32gSO2含有2NA个S=O键 |
| B、0.3 mol NO2与足量水充分反应转移的电子数目为0.2NA |
| C、1 mol碳的同位素中含有6NA个中子 |
| D、25 mL 16.0 mol?L-l浓盐酸与足量MnO2,加热反应,生成Cl2分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2+O2
| ||||
| B、O2+2NO=2NO2 | ||||
| C、H2O+3NO2═NO+2HNO3 | ||||
D、4NH3+5O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-) |
| C、常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7 mol?L-1 |
| D、物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
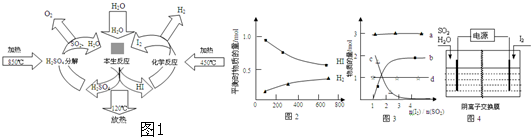
查看答案和解析>>
科目:高中化学 来源: 题型:
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com