
【题目】现有25℃时0.1mol/L的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”,“减小”或“不变”).
(填“增大”,“减小”或“不变”).
②若向氨水中加入稀硫酸,使其恰好中和,所得溶液的pH7(填“>”“<”或“=”),用离子方程式表示其原因: .
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42﹣)为 .
【答案】减小;<;NH4++H2O?NH3?H2O+H+;![]() mol/L
mol/L
【解析】解:①由于(NH4)2SO4=2NH4++SO42﹣ , 溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中液中液中 ![]() 减小;所以答案是:减小;②硫酸和氨水反应生成硫酸铵和水,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,则所得溶液的pH<7,水解方程式为:NH4++H2ONH3 . H2O+H+;所以答案是:<,NH4++H2ONH3H2O+H+;③溶液呈中性,则溶液中c(H+)=c(OH﹣),溶液呈电中性,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42﹣ )+c(OH﹣),所以c(SO42﹣ )=
减小;所以答案是:减小;②硫酸和氨水反应生成硫酸铵和水,硫酸铵是强酸弱碱盐水解而使其溶液呈酸性,则所得溶液的pH<7,水解方程式为:NH4++H2ONH3 . H2O+H+;所以答案是:<,NH4++H2ONH3H2O+H+;③溶液呈中性,则溶液中c(H+)=c(OH﹣),溶液呈电中性,溶液中存在电荷守恒c(NH4+)+c(H+)=2c(SO42﹣ )+c(OH﹣),所以c(SO42﹣ )= ![]() c(NH4+)=
c(NH4+)= ![]() mol/l;所以答案是:
mol/l;所以答案是: ![]() mol/l.
mol/l.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】有aXn-、bYm+两种离子,其电子层结构相同。下列关系或化学式正确的是( )
A.a-n=b+mB.a+m=b+nC.氧化物YOmD.X的氢化物为HnX或XHn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同种物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A.3Br2+6KOH=5KBr+KBrO3+3H2O
B.MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
C.2KNO3 ![]() 2KNO2+O2↑
2KNO2+O2↑
D.NH4NO3 ![]() N2O↑+2H2O
N2O↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如图所示,则下列说法正确的是( )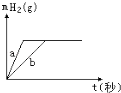
A.投入的Na、K一定等质量
B.投入的Na的质量小于K的质量
C.曲线a为Na,b为K
D.稀盐酸的量一定是不足量的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于溶液的叙述正确的是( )
A. 所有溶液都是无色的
B. 由分散质和分散剂组成的分散系一定是溶液
C. 均一稳定的液体是溶液
D. 溶液是由溶质和溶剂组成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏伽德罗常数的值)( )
A.1mol N2中含有的电子数为2NA
B.标准状态下,22.4L水所含的氧原子数为NA
C.23g钠在化学反应中失去电子数目为10 NA
D.2g氢气所含的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(ρ=1.84g/cm3)配制500ml0.5mol/L的稀H2SO4 , 请按要求填空:
(1)所需浓H2SO4的体积为
(2)如果实验室有10mL、20mL、50mL量筒,应选用mL量筒,实验中用到的仪器除了烧杯、玻璃棒之外,还需要的仪器有:
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷至室温即转移到容量瓶
②定容时俯视刻度线
③所用过的烧杯、玻璃棒未洗涤 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核裂变产生的核能可以用于发电, ![]() U是一种常用的核燃料,下列说法错误的是( )
U是一种常用的核燃料,下列说法错误的是( )
A.![]() U相对原子质量为235
U相对原子质量为235
B.![]() U中的中子数为92
U中的中子数为92
C.![]() U与
U与 ![]() C的质量比约为235:12
C的质量比约为235:12
D.![]() U 与
U 与 ![]() U互称为同位素
U互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: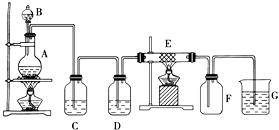
(1)C、G两个装置所盛放的试剂分别是:
CG .
(2)①装置搭好须进行气密性检查,写出操作方法: .
②两处酒精灯应先点燃处(填写A或B),目的是 .
③F中的现象为 , G中出现了一种沉淀,该沉淀的化学式 .
(3)写出在A、E中发生反应的化学方程式为:
A: .
E: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com