
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 向氯乙烷中加入硝酸银溶液,可以快速鉴定其中的氯原子 | |
| C. | 将等体积的苯、汽油和水在试管中充分振荡后静置,现象如图 | |
| D. | 直馏汽油和裂化汽油中分别滴加溴水可以观察到不同现象 |
科目:高中化学 来源: 题型:实验题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K越大,达到平衡时,反应进行的程度越大 | |
| B. | K越小,达到平衡时,反应物的转化率越大 | |
| C. | K随反应物浓度的改变而改变 | |
| D. | K随温度和压强的改变而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0g | B. | 2.0g | C. | 2.5g | D. | 3.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
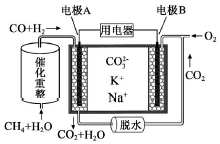
| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$ 3H2+CO,每消耗1molCH4转移12mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HCN |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 |
| A. | 体积和pH相同的CH3COOH溶液与HCN溶液,分别与足量的Fe反应,HCN溶液产生的H2更多 | |
| B. | 体积和pH相同的CH3COOH溶液与HCN溶液,中和NaOH溶液所消耗NaOH的物质的量相同 | |
| C. | amol•L-1HCN溶液加水稀释后,电离平衡常数减小,加入KCN晶体后,电离平衡常数增大 | |
| D. | 25℃时,在等浓度的CH3COOH溶液与HCN溶液中,水的电离程度前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①③⑤⑥ | C. | ①③⑥⑦ | D. | ②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com