
【题目】下列各组中两种微粒所含电子数不相等的是
A.![]() 和
和![]()
B.CO和![]()
C.![]() 和
和![]()
D.![]() 和
和![]()
【答案】D
【解析】
粒子中质子数等于原子的质子数之和,中性微粒中质子数=电子数,阳离子的电子数=质子数-电荷数,阴离子的电子数=质子数+电荷数.
A、H3O+的质子数为11,电子数为11-1=10,OH-的质子数为9,电子数为9+1=10,电子数相同,故A错误;
B、CO的质子数为14,电子数为14,N2的质子数为14,电子数为14,电子数相同,故B错误;
C、HNO3的质子数为1+7+8×3=32,电子数为32,NO3-的质子数为7+8×3=31,电子数为31+1=32,电子数相同,故C错误;
D、CH3+的质子数为6+1×3=9,电子数为9-1=8,NH4+的质子数为11,电子数为11-1=10,电子数不同,故D正确.
故选:D.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】
两名日本科学家与一名美国科学家利用钯作催化剂,将有机物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而获2010年诺贝尔化学奖。下列说法正确的是( )
A. 有机物中一定含有碳和氢两种元素
B. 一定条件下,使用催化剂能提高反应的平衡转化率
C. 将有机物进行“缝合”可以不遵循原子守恒定律
D. 将有机物进行“裁剪”需要破坏旧的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室纯盐的流程如下:
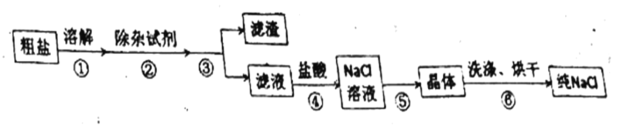
请回答:
(1)步骤③、⑤的操作名称是_______、_______。
(2)粗盐中含有![]() 、
、![]() 、
、![]() 等杂质离子,步骤②所用的除杂试剂有:①碳酸钠溶液;②氯化钡溶液;③氢氧化钠溶液,则加入试剂的顺序_______(填编号)。
等杂质离子,步骤②所用的除杂试剂有:①碳酸钠溶液;②氯化钡溶液;③氢氧化钠溶液,则加入试剂的顺序_______(填编号)。
a.②③① b.①②③ c.③②① d.③①②
(3)除杂过程中,加入![]() 溶液的目的是_____________。
溶液的目的是_____________。
(4)步骤④判断加入的盐酸“适量”的方法是______________________,步骤⑤加热时要用玻璃棒搅拌,这是为了防止________,加热到_________时,停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与浓硝酸反应的方程式为:![]()
(1)在该反应中,被还原的元素是_______,氧化产物是_______。
(2)在方程式标出电子转移的方向和数目_______。
(3)若有32g铜参与反应,被还原的硝酸有_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
反应的热化学方程式为___________________________________________。
又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是___________kJ。
(2)已知: C(s)+ O2(g) = CO2(g) △H2=-393.5kJ/mol
H2(g)+1/2 O2(g) =H2O(g) △H3 = -241.8 kJ/mol
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中 C与 H2的物质的量之比为___________________。
(3)盖斯定律在生产和科学研究中有很重要的意义。现根据下列2个热化学方程式: Fe2O3(s)+3CO(g)=Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=2FeO(s)+CO2(g) ΔH=+411.2kJ/mol
写出CO(g)还原FeO(s)得到Fe(s)和CO2(g)的热化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.可逆反应2Cl2(g)+2H2O(g)![]() 4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
(1)降低温度,Cl2的转化率 ________;v正 ________________;
(2)保持容器体积不变,加入He,则HCl的物质的量 _______________________.
(3)保持容器压强不变,加入He,则O2的体积分数 ______________________;
(4)若温度和体积不变,反应从Cl2和H2O开始至平衡,在这个变化过程中,容器内气体的密度 ____________,相对分子质量 ______________________.
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJmol-1、286kJmol-1、726kJmol-1.
利用CO、H2合成液态甲醇的热化学方程式为____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2-、碳氢化合物大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:汽车尾气中的CO、NOx、碳氮化合物是大气污染物。使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol K1(该反应的平衡常数)
2C(s)+O2(g)=2CO(g) △H2=-221kJ/mol K2(同上)
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol K3(同上)
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式_________,以及该热化学方程式的平衡常数K=________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2 △H=-1200kJ/mol。
4CO2+N2 △H=-1200kJ/mol。
①某温度下,在2L密闭容器中充入0.lmolNO2和02m1CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的29/30,则反应开始到平衡时NO2的平均反应速率v(NO2)=_________mol/(L·s)。
②若容器中观察到____________________________,可判断该反应达到平衡状态;
③能使该反应的反应速率增大,且平衡向逆反应方向移动的是_______。
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
(3)电化学降解NO2-的原理如图:

阴极反应式为_____________________________________。
(4)在高效催化剂作用下可用NH3还原NO2进行污染物处理。
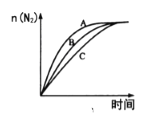
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图。活化能最小的是________[用E(A)、E(B)、E(C)表示三种催化剂下该反应的活化能]。
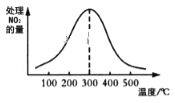
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图。试说明图中曲线先增大后减小的原因____________________________________________________(假设该温度范围内催化剂的催化效率相同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。A和G均为气体,其中A为黄绿色。C和D均为酸,其中C具有漂白性。E和I均为常见金属,其中I为紫红色。
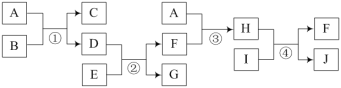
⑴气体A所含元素在周期表中的位置是:______。D的电子式为______。
⑵写出反应①的离子方程式:______。
⑶写出反应④的化学方程式,并用单线桥表示电子转移的方向和数目:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com