
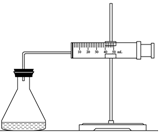
 ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��
ʵ������H2O2�ֽⷴӦ��ȡ����ʱ������������Լӿ췴Ӧ���ʣ�ij�о���ѧϰС��Ϊ�о�����FeCl3������O2�������ʵ�Ӱ�죬�������������ʵ�鷽�������±������������������Լ���һ�������Ϻ���з�Ӧ��| ʵ���� �Լ� | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
���� ��1������װ�������Եķ����ǣ���ע����������������һ�Σ���һ������Ƿ�ص�ԭλ��
��2����������ͬʱ�����ռ�������������ռ���ͬ�����������Ҫ��ʱ��ȽϷ�Ӧ���ʣ�
��3��ʵ��ʵ��Ŀ�ģ�Ӧʹ��Ӧ���Ũ����ͬ���������ͬ��
��4��ʵ����Cʹ�õĴ�����ࣻ
��5���ܷ�ӦΪ2H2O2�T2H2O+O2������һ����ӦΪ2Fe3++H2O2�T2Fe2++O2��+2H+���Դ˷����ڶ�����Ӧ��
��� �⣺��1������װ�������Եķ����ǣ���ע����������������һ�Σ���һ�������ص�ԭλ��˵�����������ã�
�ʴ�Ϊ����ע����������������һ�Σ���һ�������ص�ԭλ��˵�����������ã�
��2����װ�ÿ�֪����Ͳ���ռ����壬���������ͬʱ�����ռ�������������ռ���ͬ�����������Ҫ��ʱ��ȽϷ�Ӧ���ʣ�
�ʴ�Ϊ����ͬʱ�����ռ�������������ռ���ͬ�����������Ҫ��ʱ�䣻
��3���о�����FeCl3������O2�������ʵ�Ӱ��ʵ��ʵ��Ŀ�ģ�Ӧʹ��Ӧ���Ũ����ͬ���������ͬ����V1=V2=20.0mL����C��֪�����Ϊ30.0mL����V3=30.0-20.0=10.0mL��V4=30.0-20.0-5.0=5.0mL��
�ʴ�Ϊ��20.0��20.0��10.0��5.0��
��4��ʵ����Cʹ�õĴ�����࣬��Ӧ������죬�ʴ�Ϊ��C��
��5���ܷ�ӦΪ2H2O2�T2H2O+O2������һ����ӦΪ2Fe3++H2O2�T2Fe2++O2��+2H+�����ܷ�Ӧ��ȥ��һ����ӦΪ�ڶ�����Ӧ2Fe2++H2O2+2H+�T2Fe3++2H2O��
�ʴ�Ϊ��2Fe2++H2O2+2H+�T2Fe3++2H2O��
���� ���⿼�黯ѧ��Ӧ���ʵIJⶨ��Ӱ�����أ�ע���о������Է�Ӧ��Ӱ��Ӧ�̶�Ũ�ȵ����ز��䣬ע����Ʊ�������Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
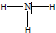 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Oԭ�ӵĽṹʾ��ͼ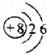 | B�� | CH4���ӵı���ģ�� | ||
| C�� | C2H2���ӵĽṹʽCH��CH | D�� | N2���ӵĵ���ʽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�� ��� | ʵ��Ŀ�� | ��ʼpH | ��ˮ��Ʒ���/mL | CuSO4��Һ�����/mL | ˫��ˮ��Һ�����/mL | ����ˮ�����/mL |
| �� | Ϊ����ʵ������ο� | 7 | 60 | 10 | 10 | 20 |
| �� | ��ˮ�ij�ʼpH�����跴Ӧ���ʵ�Ӱ�� | 12 | 60 | 10 | 10 | 20 |
| �� | ˫��ˮ��Ũ�ȶ����跴Ӧ���ʵ�Ӱ�� | 7 | 60 | 10 | 20 | 10 |
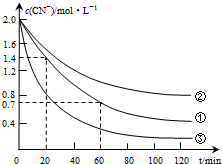
| ʵ�鲽�裨��Ҫд������������̣� | Ԥ��ʵ������ͽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij��ѧ��ȤС��Ϊ�˲ⶨij���ᾧ��Ĵ��ȼ������ữ�ĸ��������Һ����ᣨH2C2O4����Һ��Ӧ�Ļ�ѧ��Ӧ���ʴ�С��Ӱ�����أ����������ʵ�飮��ѧ��Ӧ���£�
ij��ѧ��ȤС��Ϊ�˲ⶨij���ᾧ��Ĵ��ȼ������ữ�ĸ��������Һ����ᣨH2C2O4����Һ��Ӧ�Ļ�ѧ��Ӧ���ʴ�С��Ӱ�����أ����������ʵ�飮��ѧ��Ӧ���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ij�¶��£���Ӧ��$\frac{c��C{l}^{-}��}{c��Cl{O}^{-}��}$=11������Һ��$\frac{c��Cl{O}^{-}��}{c��Cl{O}_{3}^{-}��}$=$\frac{1}{2}$ | |
| B�� | �μӷ�Ӧ�����������ʵ�������$\frac{1}{2}$ a mol | |
| C�� | �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��$\frac{1}{2}$ a mol��ne��$\frac{5}{6}$ a mol | |
| D�� | �ı��¶ȣ�������KClO3��������۲���Ϊ$\frac{1}{7}$a mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2XO3 | B�� | HXO3 | C�� | H3XO3 | D�� | H2XO4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com