
 .
. 分析 (1)形成于同种原子间的为非极性键,形成于不同种原子间的为极性键;
(2)双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
解答 解:(1)①H2O2中H原子和O原子间为极性共价键,O原子与O原子间为极性共价键;
②KCl中为离子键;
③Na2SO4中钠离子和硫酸根之间为离子键,在硫酸根中的S原子和O原子间为极性共价键;
④Na2O2中钠离子和过氧根之间为离子键,在过氧根中的O原子和O原子间为非极性键家;
⑤HCl间为极性共价键;
⑥O2中为非极性共价键.
故只含极性键的是⑤;只含非极性键的是⑥,既含离子键又含非极性键的是④,既极性键含又含离子键的是③,故答案为:⑤;⑥;④;③;
(2)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:
,故答案为: ;
;
点评 本题考查了电子式的书写和化学键种类的判断,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 向0.10 mol•L-1 NH4HCO3溶液中通CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10 mol•L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10 mol•L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10 mol•L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量铁屑反应 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚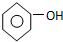 +CO32-→ +CO32-→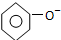 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未来化学的研究方向是经验化 | B. | 化学不需要再做实验 | ||
| C. | 化学不再是纯实验学科 | D. | 化学不做实验,就什么都不知道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:
绿矾受热分解后的产物为不含硫元素的固体A、SO2、SO3和H2O.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
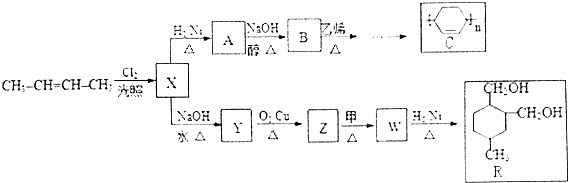
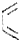 +
+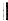 $\stackrel{△}{→}$
$\stackrel{△}{→}$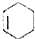
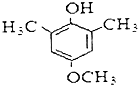 .
.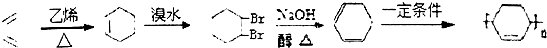 .(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
.(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1.0L0.1 mol/•LNa2S溶液中含有的S2-离子数为0.1NA | |
| B. | 一定条件下,4.6g的Na完全与O2反应生成7.2g产物时失去的电子数为0.2NA | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 电镀铜时,若阴极得到电子数为2NA,则阳极质量减少不一定等于64g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com