
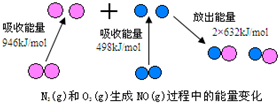
分析 (1)根据拆开1mol某化学键所吸收的能量看成该化学键的键能,结合图示即可解答;根据反应热等于反应物的总键能减去生成物的总键能计算,标注物质聚集状态和对应反应的焓变书写热化学方程式;
(2)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式.
解答 解:(1)由图可知:N≡N键的键能为946kJ•mol-1,反应热=反应物总键能-生成物总键能=946kJ•mol-1+498kJ•mol-1-2×632kJ•mol-1=180 kJ•mol-1,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1;
故答案为:946;N2(g)+O2(g)═2NO(g)△H=+180 kJ•mol-1;
(2)①已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ•mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599.2kJ•mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$得到,
所以反应焓变△H=2×(-393.5kJ•mol-1)+(-571.6kJ•mol-1)×$\frac{1}{2}$-(-2599.2kJ•mol-1)×$\frac{1}{2}$=+226.8kJ•mol-1,
故答案为:+226.8.
点评 本题考查了反应热的计算,题目难度中等,注意反应热△H的单位与符号、利用键能计算反应焓变、盖斯定律计算应用,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 加热 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取5.26mL稀硫酸 | |
| B. | 用托盘天平称量11.7g氧化铜粉末 | |
| C. | 用广泛pH试纸测得某溶液的pH为3.5 | |
| D. | 用酸式滴定管量取10.5mL盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg与Cl2完全反应,失去电子的数目为0.2NA | |
| B. | 标准状况下,NA个SO3分子所占的体积约为22.4L | |
| C. | 1mol Cl2与H2完全反应,转移的电子数目为NA | |
| D. | CO2的摩尔质量等于NA个CO2分子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
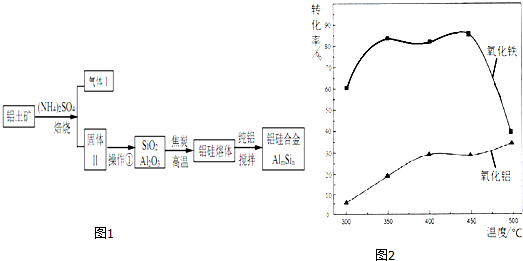
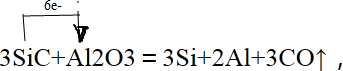 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com