
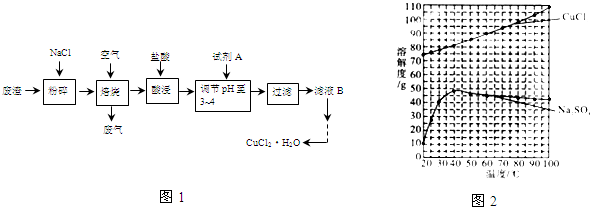
| ||
| ||


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
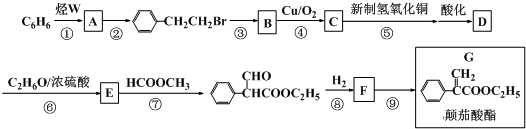
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
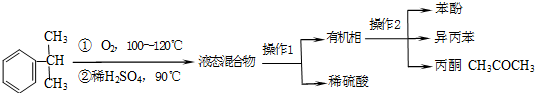
| 物质 | 沸点 | 溶解性 | 主要化学性质 |
| 异丙苯 | 152.4℃ | 不溶于水,易溶于酒精. | 可被强氧化剂氧化 |
| 苯酚 | 181.8℃ | 微溶于冷水,易溶于热水和酒精等有机溶剂. | 易被氧化 |
| 丙酮 | 56.2℃ | 易溶于水和有机溶剂 | 不易被氧化 |
| 检验项目 | 实验方案 |
| 检验丙酮中一定存在有机杂质的方法是 | A.酸性KMnO4溶液,加热 B.乙醇,溶解 C.NaOH溶液(酚酞),加热 |
| 检验丙酮中一定含有苯酚的方案是: | 取少许待测液置于试管中,滴加1~2滴FeCl3溶液.预期的实验现象和结论是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
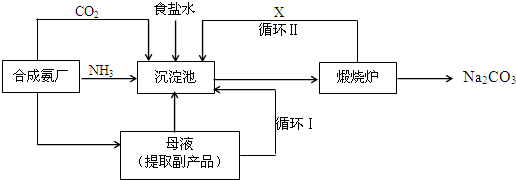
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取8.0g胆矾使其溶于500mL水中 |
| B、称取12.5g胆矾使其溶于500mL水中 |
| C、称取12.5g胆矾使其溶于适量水中,再加水稀释至500mL. |
| D、称取8.0g胆矾使其溶于375g水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com