
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。
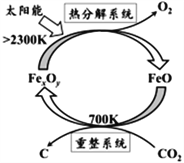
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
【答案】 Fe3O4 2 mol < 4 (mol/L)-3 增大压强(或增大H2(g)浓度、移走产物) > NH3·H2O(aq)+ CO2(g) ![]() NH (aq)+HCO3- (aq) ΔH1=(a+b+c)kJ·mol-1 1.25×10-3
NH (aq)+HCO3- (aq) ΔH1=(a+b+c)kJ·mol-1 1.25×10-3
【解析】试题分析:(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中![]() ,根据Fe原子、O原子守恒计算FexOy的化学式;热分解系统中是Fe3O4分解为FeO与氧气,反应方程式为
,根据Fe原子、O原子守恒计算FexOy的化学式;热分解系统中是Fe3O4分解为FeO与氧气,反应方程式为![]() ,根据方程式计算分解lmolFexOy转移电子的物质的量;(2) ①根据图像,升高温度,氢气物质的量增加,平衡逆向移动;②利用“三段式”计算TA温度下的平衡常数;③根据平衡移动分析;④根据投料时的浓度熵与平衡常数的比较,分析反应进行方向;(3)根据盖斯定律计算利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式;②NH4++HCO3-+H2O-=NH3·H2O+H2CO3的平衡常数K=
,根据方程式计算分解lmolFexOy转移电子的物质的量;(2) ①根据图像,升高温度,氢气物质的量增加,平衡逆向移动;②利用“三段式”计算TA温度下的平衡常数;③根据平衡移动分析;④根据投料时的浓度熵与平衡常数的比较,分析反应进行方向;(3)根据盖斯定律计算利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式;②NH4++HCO3-+H2O-=NH3·H2O+H2CO3的平衡常数K=![]() ;
;
解析:(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中![]() ,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;
,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;![]() ,分解2mol Fe3O4生成1mol氧气,转移4mol电子,所以分解1mol Fe3O4生成0.5mol氧气,转移2mol电子;(2) ①根据图像,升高温度,氢气物质的量增加,平衡逆向移动,正反应放热
,分解2mol Fe3O4生成1mol氧气,转移4mol电子,所以分解1mol Fe3O4生成0.5mol氧气,转移2mol电子;(2) ①根据图像,升高温度,氢气物质的量增加,平衡逆向移动,正反应放热![]() ;
;
②
![]() 0.5 ;
0.5 ;
③增大压强或增大H2(g)浓度,可以使平衡正向移动,CO2的平衡转化率增大;④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、1molC2H4(g)、2molH2O(g)进行投料,![]() ,所以反应正向进行,v(正)>v(逆);
,所以反应正向进行,v(正)>v(逆);
(3)①NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) △H1=akJ/mol
NH4+(aq)+OH-(aq) △H1=akJ/mol
②CO2(g)+H2O(1)![]() H2CO3(aq) △H2=bkJ/mol
H2CO3(aq) △H2=bkJ/mol
③H2CO3(aq)+OH-(aq)![]() HCO3-(aq)+H2O(1) △H3=ckJ/mol
HCO3-(aq)+H2O(1) △H3=ckJ/mol
根据盖斯定律①+②+③得,NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为NH3·H2O(aq)+ CO2(g)![]() NH4+ (aq)+HCO3- (aq) ΔH1=(a+b+c)kJ·mol-1;
NH4+ (aq)+HCO3- (aq) ΔH1=(a+b+c)kJ·mol-1;
②K=![]() =1.25×10-3。
=1.25×10-3。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】(题文)溶质的质量分数为14%的KOH溶液,经加热蒸发去100g水后,质量分数变成28%,体积为80mL,则此时溶液的物质的量浓度为
A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是一种治疗脑血管疾病的常用药,它可以用烃A 为原料按以下路线合成:
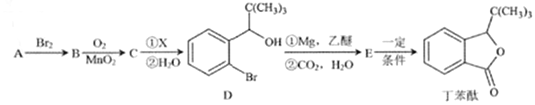
已知:I.A的质谱如下图所示;

II.C能发生银镜反应
III. 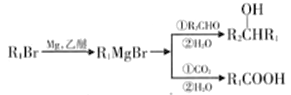
回答以下问题:
(1)A的名称是______________;丁苯酞所含官能团的名称是________________________。
(2)A→B的反应类型是________________;A→B的反应条件是___________________________。
(3)C的结构简式为________________________。
(4)E![]() 丁苯酞的反应方程式为_________________________。
丁苯酞的反应方程式为_________________________。
(5)芳香族化合物H与E所含官能团的种类和数目相同,H比E的相对分子质量小56.1mol H分别与NaOH溶液和NaHCO3溶液反应,消耗NaOH和NaHCO3的物质的量之比为2:1,则符合条件的H的结构有_____种;其中在核磁共振氡谱图中有5组吸收峰,峰面积之比为1:1:2:2:2的结构简式为_________________。
(6)参照题目信息,写出以![]() 为原料,制备
为原料,制备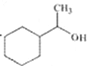 的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
的合成路线(无机试剂及2个碳原子以内的有机试剂任选):____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正己烷、2甲基戊烷、( )、2,2二甲基丁烷、2,3二甲基丁烷。在上述有机物的有规律排列中,括号内填入的物质最适宜的是 ( )
A. 正戊烷 B. 2甲基丁烷
C. 3甲基戊烷 D. 2,2二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
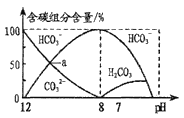
下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
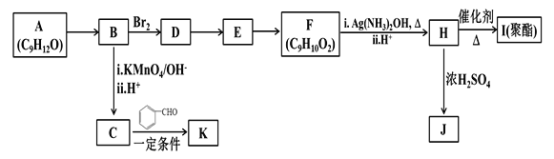
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②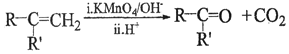
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3![]() N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
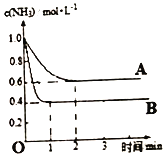
请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g)![]() 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)![]() 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 23gNa变为Na+时失去的电子数为0.2NA B. 18g水所含的电子数为NA
C. 8g He所含的分子数为NA D. 16g O2与16g O3所含的原子数均是NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com