
 ,⑦的结构式H-O-Cl.
,⑦的结构式H-O-Cl.分析 (1)根据价层电子对判断VSEPR模型,去掉孤电子对就是其实际空间构型,价层电子对=σ 键电子对+中心原子上的孤电子对;氢氧化钾为离子化合物,电子式需要标出阴阳离子所带电荷;HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O,结合结构式及结构简式的书写方法解答;
(2)金属单质在熔融状态和固态时都能导电;
(3)一般非金属元素之间形成共价键,金属元素与非金属元素之间形成离子键;
(4)分子晶体中存在分子间作用力;
(5)晶体中每个Cl-同时吸引着6个Na+,每个钠离子同时吸引着6个氯离子;
(6)利用均摊法计算C原子数与C-C键数之比.
解答 解:(1)CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,氢氧化钾为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ,HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O,结构式为:H-O-Cl,
,HClO为共价化合物,分子中存在1个O-H键和1个Cl-O键,中心原子为O,结构式为:H-O-Cl,
故答案为:正四面体; ;H-O-Cl;
;H-O-Cl;
(2)金属单质在熔融状态和固态时都能导电,故选⑤,
故答案为:⑤;
(3)③NaCl中Na+和Cl-之间存在离子键,熔化时需要破坏,⑥KOH中K+和OH-之间存在离子键,熔化时需要破坏,
故答案为:③⑥;
(4)通过分子间作用力互相结合形成的晶体叫做分子晶体,分子晶体以分子间作用力结合形成晶体,如:所有的非金属氢化物,大多数的非金属氧化物,绝大多数的共价化合物,少数盐(如AlCl3),所以②CH4 ④干冰⑦HClO ⑧I2属于以分子间作用力结合的晶体,
故答案为:②④⑦⑧;
(5)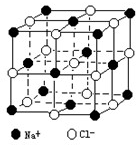 根据氯化钠的晶胞知,将钠离子和氯离子位置互换时晶胞不变,体心上的离子沿X、Y、Z三轴切割知,X、Y、Z轴上与钠离子最近的氯离子个数都是2,所以钠离子的配位数=2×3=6,每一个Na+周围与它最近且等距离的Cl-有6个,
根据氯化钠的晶胞知,将钠离子和氯离子位置互换时晶胞不变,体心上的离子沿X、Y、Z三轴切割知,X、Y、Z轴上与钠离子最近的氯离子个数都是2,所以钠离子的配位数=2×3=6,每一个Na+周围与它最近且等距离的Cl-有6个,
故答案为:6;
(6)金刚石的晶胞结构如图所示: ,金刚石晶体中每个C原子处于其他4个C原子构成的正四面体的内部,向周围无限延伸形成空间立体网状结构,最小的环是立体六元环,每个C原子周围有4条共价键,而每2个碳原子形成1个共价键,则金刚石晶体中C原子数与C-C键数之比为1:2,
,金刚石晶体中每个C原子处于其他4个C原子构成的正四面体的内部,向周围无限延伸形成空间立体网状结构,最小的环是立体六元环,每个C原子周围有4条共价键,而每2个碳原子形成1个共价键,则金刚石晶体中C原子数与C-C键数之比为1:2,
故答案为:2:1.
点评 本题考查了晶体的结构、化学键的判断、化学键和物质的关系等,根据物质中存在的化学键、离子键和共价键的概念分析解答,注意化合物和物质导电的关系,注意金刚石的结构特点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2 2 1 3 | B. | 3 1 2 2 | C. | 6 1 2 4 | D. | 2 3 2 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 | |
| B. | 元素X与元素Y能形成两种化学键类型完全相同的化合物 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR | |
| D. | 元素X、Z形成化合物的电子式可以表示成. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质均是由分子构成,分子均是由原子构成的 | |
| B. | 某物质经测定,只含有一种组成元素,则该物质一定是单质 | |
| C. | 碱性氧化物均是金属氧化物,酸性氧化物均是非金属氧化物 | |
| D. | 纯净的硫酸是纯净物,而纯净的盐酸是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:
已知:Br2常温下呈液态,易挥发,有毒;如图为实验室模拟工业过程从浓缩的海水中提取溴的实验装置.其实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是高级脂肪酸和甘油形成的酯,属纯净物 | |
| B. | 油脂都不能与溴水反应 | |
| C. | 油脂的硬化属于酯化反应 | |
| D. | 天然油脂没有恒定的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 15:13 | C. | 7:8 | D. | 8:7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com