
| 19.2g |
| 64g/mol |
| 19.2g |
| 64g/mol |
| 3mol |
| 0.3mol |
| 44.8L |
| x |


科目:高中化学 来源: 题型:
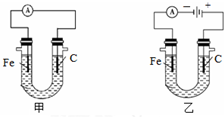 如图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究.请回答:
如图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、盐桥中的K+向负极移动 |
| B、负极电极反应方程式为:CH3OH-6e-+8OH-═CO32-+6H2O |
| C、每消耗1mol甲醇,需消耗33.6L标况下的氧气 |
| D、正极烧杯中溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、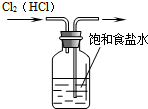 除去Cl2中的HCl杂质 |
B、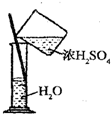 稀释浓硫酸 |
C、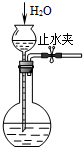 检查装置气密性 |
D、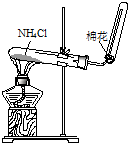 实验室制取NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
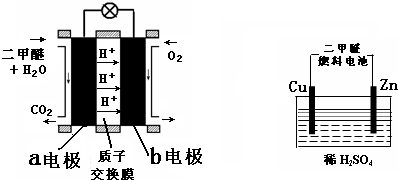
查看答案和解析>>
科目:高中化学 来源: 题型:
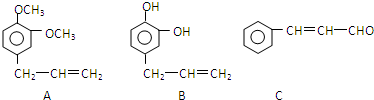
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
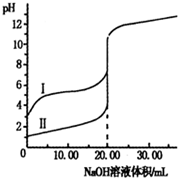 室温下,用0.1000mol?L-1.NaOH溶液分别滴定体积均为20.00mL的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1000mol?L-1.NaOH溶液分别滴定体积均为20.00mL的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A、I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B、盐酸和醋酸的浓度均为0.1000mol?L-1 |
| C、pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D、V(NaOH)=20.00mL时,c(Cl-)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业电解饱和食盐水:2Cl-+H2O=Cl2↑+H2↑+OH- | ||
| B、碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | ||
C、硫酸铝溶液中滴加过量浓氨水:Al3++4OH-═AlO
| ||
| D、用过氧化氢从酸化海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com