
”¾ĢāÄæ”æŅŃÖŖŌŖĖŲA”¢B”¢C”¢DŗĶEµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó”£A”¢B”¢C”¢DĖÄÖÖŌŖĖŲŗĖµēŗÉŹż¾łŠ”ÓŚ20£¬A”¢BĶ¬Ö÷×壻B”¢C”¢DŌŖĖŲµÄ»łĢ¬Ō×Ó¾ßÓŠĻąĶ¬µÄÄÜ²ćŹż£¬ĖüĆĒµÄ»łĢ¬Ō×ÓÖŠpÄܼ¶ÉĻĪ“³É¶Ōµē×ÓŹż·Ö±šĪŖ1”¢3”¢1£»EŹĒÖÜĘŚ±ķÖŠ£Ø³ż·ÅÉäŠŌŌŖĖŲĶā£©µŚŅ»µēĄėÄÜ×īŠ”µÄŌŖĖŲ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĻĀĮŠŌŖĖŲµÄ·ūŗÅ£ŗA ”¢E ”£
£Ø2£©CŌŖĖŲµÄ¼Ūµē×ÓÅŲ¼Ķ¼ĪŖ£ŗ £»
øĆÅŲ¼×ńѵÄŌĄķÖ÷ŅŖÓŠ£ŗ £Ø“šĶźÕūµĆ·Ö£©”£
£Ø3£©C”¢DŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖ÷ŅŖÓŠ£ŗ £ØĢī»ÆѧŹ½£¬“šĶźÕūµĆ·Ö£©£»ĘäÖŠĻą¶Ō·Ö×ÓÖŹĮæ½ĻŠ”µÄ·Ö×ÓĪŖ ·Ö×Ó£ØĢī”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±£©£¬øĆ·Ö×ÓµÄæռ乹ŠĶĪŖ £¬ÖŠŠÄŌ×ÓµÄŌӻƷ½Ź½ŹĒ ”£
£Ø4£©»ÆŗĻĪļBD3µÄČŪµć190”ę”¢·Šµć182.7”ę£¬ÄĒĆ“BD3µÄ¾§ĢåĄąŠĶĪŖ £»ŹĀŹµÉĻ£¬ŌŚBD3µÄ»ÆŗĻĪļÖŠĶłĶłŅŌB2D6µÄŠĪŹ½“ęŌŚ£¬øĆŠĪŹ½µÄ“ęŌŚŹĒÓÉÓŚ ŠĪ³ÉµÄ”££ØŃ”Ģī”°Ēā¼ü”±”¢”°·¶µĀ»ŖĮ¦”±”¢”°Ąė×Ó¼ü”±”¢”°ÅäĪ»¼ü”±£©
£Ø5£©ĻĀĶ¼ĪŖ¼øÖÖ¾§°ū£Ø»ņ¾§°ūµÄ1/8£©Ź¾ŅāĶ¼£¬ĘäÖŠ![]() ŗĶ
ŗĶ![]() “ś±ķĮ½ÖÖ²»Ķ¬µÄĮ£×Ó”£EÓėDŠĪ³ÉµÄ»ÆŗĻĪļµÄ¾§°ūŹĒĻĀĮŠÖŠµÄ £ØĢīŠņŗÅ£©£¬ŌŚøĆ¾§°ūÖŠŃōĄė×ÓµÄÅäĪ»ŹżĪŖ ”£
“ś±ķĮ½ÖÖ²»Ķ¬µÄĮ£×Ó”£EÓėDŠĪ³ÉµÄ»ÆŗĻĪļµÄ¾§°ūŹĒĻĀĮŠÖŠµÄ £ØĢīŠņŗÅ£©£¬ŌŚøĆ¾§°ūÖŠŃōĄė×ÓµÄÅäĪ»ŹżĪŖ ”£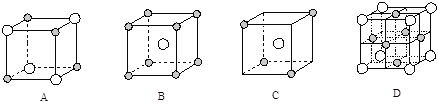
”¾“š°ø”æ£Ø1£©B Cs £Ø2£©![]() ¹¹ŌģŌĄķ”¢ÅŻĄūŌĄķ”¢ŗéĢŲ¹ęŌņ
¹¹ŌģŌĄķ”¢ÅŻĄūŌĄķ”¢ŗéĢŲ¹ęŌņ
£Ø3£©PCl3”¢PCl5¼«ŠŌ Čż½Ē׶ŠĪ sp3
£Ø4£©·Ö×Ó¾§Ģå ÅäĪ»¼ü £Ø5£©B 8
”¾½āĪö”æ
ŹŌĢā£Ø1£©B”¢C”¢DŌŖĖŲµÄ»łĢ¬Ō×Ó¾ßÓŠĻąĶ¬µÄÄÜ²ćŹż£¬ĖüĆĒµÄ»łĢ¬Ō×ÓÖŠpÄܼ¶ÉĻĪ“³É¶Ōµē×ÓŹż·Ö±šĪŖ1”¢3”¢1£¬ĒŅŌ×ÓŠņŹżŅĄ“ĪµŻŌö£¬¶¼Š”ÓŚ20£¬ĖłŅŌBŹĒÅš»ņĀĮŌŖĖŲ£¬ÓÉÓŚAŗĶBŹĒĶ¬Ö÷×åµÄ£¬ĒŅAµÄŌ×ÓŠņŹż×īŠ”£¬ĖłŅŌBŹĒAl£¬AŹĒB£¬ŌņCŹĒP£¬DŹĒCl”£EŹĒÖÜĘŚ±ķÖŠ£Ø³ż·ÅÉäŠŌŌŖĖŲĶā£©µŚŅ»µēĄėÄÜ×īŠ”µÄŌŖĖŲ£¬ÓÉÓŚ½šŹōŠŌŌ½Ē棬µŚŅ»µēĄėÄÜŌ½Š”£¬ĖłŅŌEŹĒCs”£
£Ø2£©øł¾Ż¹¹ŌģŌĄķæÉÖŖ£¬PŌŖĖŲµÄ¼Ūµē×ÓÅŲ¼Ķ¼ĪŖ![]() £¬øĆÅŲ¼Ķ¼³żĮĖ×ńŃ¹¹ŌģŌĄķĶā£¬»¹×ńŃĮĖÅŻĄūŌĄķ”¢ŗéĢŲ¹ęŌņ”£
£¬øĆÅŲ¼Ķ¼³żĮĖ×ńŃ¹¹ŌģŌĄķĶā£¬»¹×ńŃĮĖÅŻĄūŌĄķ”¢ŗéĢŲ¹ęŌņ”£
£Ø3£©PŗĶClŠĪ³ÉµÄ»ÆŗĻĪļÓŠPCl3”¢PCl5”£ĘäÖŠĻą¶Ō·Ö×ÓÖŹĮæ½ĻŠ”µÄPCl3£¬ÓÉÓŚPŌ×Óŗ¬ÓŠ1¶Ō¹Ā¶Ōµē×Ó£¬ĖłŅŌŹĒČż½Ē׶ŠĪ½į¹¹£¬ŹōÓŚ¼«ŠŌ·Ö×Ó£¬¶ųÖŠŠÄŌ×ÓPŌ×ÓŹĒsp3ŌӻƔ£
£Ø4£©øł¾ŻĀČ»ÆĀĮµÄČŪ·Šµć½ĻµĶæÉÖŖ£¬øĆ»ÆŗĻĪļŠĪ³ÉµÄ¾§ĢåÓ¦øĆŹĒ·Ö×Ó¾§Ģ唣ÓÉÓŚĀČŌŖĖŲŗ¬ÓŠ¹Ā¶Ōµē×Ó£¬¶ųĀĮŌŖĖŲŗ¬ÓŠæÕ¹ģµĄ£¬ĖłŅŌ»¹æÉŅŌŠĪ³ÉÅäĪ»¼ü”£
£Ø5£©ĀČ»Æļ¤ŠĪ³ÉµÄ¾§ĢåŹĒĄė×Ó¾§Ģ壬¾§ĢåÖŠÅäĪ»ŹżŹĒ8£¬ĖłŅŌ“š°øŃ”B”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ ”£ŹŅĪĀĻĀÓĆ
”£ŹŅĪĀĻĀÓĆ![]() µÄ
µÄ![]() µĪ¶Ø
µĪ¶Ø![]() ijŅ»ŌŖĖį
ijŅ»ŌŖĖį![]() µÄ½į¹ūČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
µÄ½į¹ūČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ

A. ![]() ŹōÓŚČõĖį
ŹōÓŚČõĖį
B. Õūøö¹ż³ĢÖŠ£¬![]() µćŹ±Ė®µÄµēĄė³Ģ¶Č×ī“ó
µćŹ±Ė®µÄµēĄė³Ģ¶Č×ī“ó
C. ![]() µć¶ŌÓ¦ŅŗÖŠ
µć¶ŌÓ¦ŅŗÖŠ![]()
D. ![]() µÄŹżĮ漶ĪŖ
µÄŹżĮ漶ĪŖ![]()
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijŠ”×éŌŚŹµŃéŹŅŃŠ¾æČܼĮ¶ŌäåŅŅĶéÓėĒāŃõ»ÆÄĘ·“Ó¦µÄÓ°Ļģ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ŹµŃé1£ŗ½«äåŅŅĶéÓėŹŹĮæNaOHĖ®ČÜŅŗ»ģŗĻ£¬¼ÓČČ”£
(1)¼ģŃéBr©£ŗČ”·“Ó¦ŗóĖłµĆ___²ćŅŗĢå(Ģī”°ÉĻ”±»ņ”°ĻĀ”±)£¬ĻņĘäÖŠ¼ÓČė________(ĢīŹŌ¼Į)£¬¹Ū²ģµ½ÓŠµ»ĘÉ«³ĮµķÉś³É”£
(2)¼ģŃéŅŅ“¼£ŗÓĆ__________________(Ģī²ØĘ×Ćū³Ę)¼ģŃéÉś³ÉĪļÖŠÓŠŅŅ“¼£¬ÓÉ“ĖæÉÖŖøĆ·“Ó¦ĄąŠĶĪŖ_____________”£
ŹµŃé2£ŗ½«äåŅŅĶéÓėŹŹĮæNaOHŅŅ“¼ČÜŅŗ»ģŗĻ£¬¼ÓČČ”£
(3)¼ģŃéŅŅĻ©£ŗ½«·“Ó¦²śÉśµÄĘųĢåĶØČėÓŅ²ąŹŌ¹ÜÖŠ£¬¹Ū²ģµ½ČÜŅŗĶŹÉ«£¬ŹŌ¼ĮXŹĒ_____________
(4)Š“³öäåŅŅĶéÓėNaOHŅŅ“¼ČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½_________________
ŹµŃé½įĀŪ£ŗ
(5)ÓÉŹµŃé1”¢2µĆ³öµÄ½įĀŪŹĒ_______________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®¹øÖŠŗ¬ÓŠµÄCaSO4£¬æÉĻČÓĆNa2CO3ČÜŅŗ“¦Ąķ£¬Ź¹Ö®×Ŗ»ÆĪŖŹčĖÉ”¢Ņ×ČÜÓŚĖįµÄCaCO3”£Ä³»ÆѧŠĖȤŠ”×éÓĆijÅØ¶ČµÄNa2CO3ČÜŅŗ“¦ĄķŅ»¶ØĮæµÄCaSO4¹ĢĢ壬²āµĆĖł¼ÓNa2CO3ČÜŅŗĢå»żÓėČÜŅŗÖŠ-lgc(CO32-)µÄ¹ŲĻµČēĻĀ”£
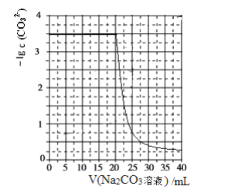
ŅŃÖŖKsp(CaSO4)=9”Į10-6£¬Ksp(CaCO3)=3”Į10-9£¬lg3=0.5£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A. ĒśĻßÉĻø÷µćµÄČÜŅŗĀś×ć¹ŲĻµŹ½£ŗc(Ca2+)”¤c(SO42-)=Ksp(CaSO4)
B. CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq) K=3”Į103
CaCO3(s)+SO42-(aq) K=3”Į103
C. øĆNa2CO3ČÜŅŗµÄÅضČĪŖ1mol/L
D. ĻąĶ¬ŹµŃéĢõ¼žĻĀ£¬Čō½«Na2CO3ČÜŅŗµÄÅضČøÄĪŖŌÅØ¶ČµÄ2±¶£¬ŌņÉĻĶ¼ĒśĻßÕūĢåĻņÉĻĘ½ŅĘ1øöµ„Ī»¼“æÉ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆѧÓĆÓļ¶ŌŹĀŹµµÄ±ķŹöÕżČ·µÄŹĒ
A. “×ĖįµēĄė£ŗCH3COOH==CH3COO+ H+
B. Na2O2ÓėCO2·“Ó¦Ģį¹©O2£ŗNa2O2 +CO2==Na2CO3 + O2
C. NO2ÓėĖ®·“Ó¦ÖĘĻõĖį£ŗNO2 +H2O==H++ NO3
D. NaOHČÜŅŗ³żČ„ĀĮ±ķĆęµÄŃõ»ÆĤ£ŗAl2O3+2OH==2AlO2+H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Ē»Æ¾Ū±½ĆŃ(SPPO)ÖŹ×Ó½»»»Ä¤ŌŚČ¼ĮĻµē³ŲĮģÓņÓŠ¹ćĄ«µÄÓ¦ÓĆĒ°¾°”£ŗĻ³É¾Ū±½ĆŃ(PPO)²¢½«ĘäøÄŠŌÖʱøSPPOµÄĀ·ĻßČēĻĀ£ŗ
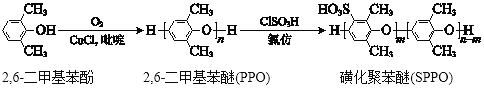
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. 2,6-¶ž¼×»ł±½·ÓÄÜÓė±„ŗĶäåĖ®·¢ÉśČ”“ś·“Ó¦
B. ³£ĪĀĻĀ2,6-¶ž¼×»ł±½·ÓŅ×ČÜÓŚĖ®
C. 2,6-¶ž¼×»ł±½·ÓÓėO2·¢ÉśŃõ»Æ·“Ӧɜ³ÉPPO
D. PPOŗĻ³ÉSPPOµÄ·“Ó¦ŹĒ£ŗ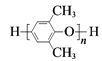 +mClSO3H
+mClSO3H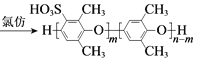 +mHCl
+mHCl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņČż·Ż0.1 ![]()
![]() , ČÜŅŗÖŠ·Ö±š¼ÓČėÉŁĮæ
, ČÜŅŗÖŠ·Ö±š¼ÓČėÉŁĮæ![]() ”¢
Ӣ![]() Ӣ
”¢![]() ¹ĢĢå(ŗöĀŌČÜŅŗĢå»ż±ä»Æ),Ōņ
¹ĢĢå(ŗöĀŌČÜŅŗĢå»ż±ä»Æ),Ōņ![]() ÅØ¶ČµÄ±ä»ÆŅĄ“ĪĪŖ( )”£
ÅØ¶ČµÄ±ä»ÆŅĄ“ĪĪŖ( )”£
A. ¼õŠ””¢Ōö“󔢼õŠ” B. Ōö“󔢼õŠ””¢¼õŠ”
C. ¼õŠ””¢Ōö“ó”¢Ōö“ó D. Ōö“󔢼õŠ””¢Ōö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æLiFePO4ŹĒŅ»ÖÖµē¶ÆĘū³µµē³ŲµÄµē¼«²ÄĮĻ£¬ŹµŃéŹŅŅŌĀĢ·ÆŗĶĮ×ĖįĪŖŌĮĻÖʱøLiFePO4µÄĮ÷³ĢČēĻĀ£ŗ

£Ø1£©”°Čܽā”±ŗĶ”°·“Ó¦1”±²½Öč²»ÄÜ»„»»µÄŌŅņŹĒ________”£
£Ø2£©”°·“Ó¦1”±µÄĄė×Ó·½³ĢŹ½ŹĒ________”£
£Ø3£©”°·“Ó¦2”±ŹĒ2LiOH£«6H2C2O4£«2FePO4===2LiFePO4£«7CO2”ü£«5CO”ü£«7H2O£¬ĘäÖŠĢåĻÖŃõ»ÆŠŌŗĶ»¹ŌŠŌµÄ·“Ó¦ĪļµÄĪļÖŹµÄĮæÖ®±ČĪŖ________”£
£Ø4£©LiFePO4ŠčŅŖŌŚøßĪĀĻĀ³ÉŠĶ²ÅÄÜ×÷ĪŖµē¼«£¬øßĪĀ³ÉŠĶŹ±ŅŖ¼ÓČėÉŁĮæ»īŠŌĢæŗŚ£¬Ęä×÷ÓĆŹĒ£ŗ¢Ł________£¬¢Ś________”£
£Ø5£©ĄūÓĆLiFePO4×÷µē¼«µÄµē³ŲĪČ¶Ø”¢°²Č«”¢¶Ō»·¾³ÓŃŗĆ£¬·ÅµēŹ±¹¤×÷ŌĄķČēĶ¼ĖłŹ¾”£·ÅµēŹ±µē¼«bµÄµē¼«·“Ó¦Ź½ĪŖ_________”£
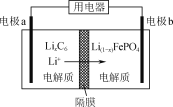
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·Ē½šŹōµ„ÖŹĮņ(S)ŹĒµ»ĘÉ«¹ĢĢå·ŪÄ©£¬ÄŃČÜÓŚĖ®”£ĪŖĮĖŃéÖ¤ĀČŌŖĖŲµÄ·Ē½šŹōŠŌ±ČĮņŌŖĖŲµÄ·Ē½šŹōŠŌĒ棬ij»ÆѧŹµŃ銔×éÉč¼ĘĮĖČēĻĀŹµŃ飬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
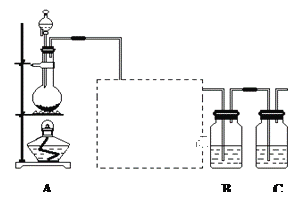
£Ø1£©×°ÖĆAµÄ·ÖŅŗĀ©¶·ÖŠŹ¢×°µÄŹŌ¼ĮŹĒ___________£¬ÉÕĘæÖŠ¼ÓČėµÄŹŌ¼ĮŹĒ___________£¬·¢ÉśµÄĄė×Ó·“Ó¦·½³ĢŹ½_____________________£»
£Ø2£©ŠéĻßæņÄŚŹĒŅ»øö×°ÓŠĪ“ÖŖŹŌ¼ĮµÄ¹ćæŚĘ棬øĆŹŌ¼ĮŹĒ___________£¬ĖµĆ÷×°ÖƵÄ×÷ÓĆ________________£»
£Ø3£©×°ÖĆBÖŠŹ¢·ÅµÄŹŌ¼ĮŹĒ______________(Ń”ĢīĻĀĮŠĖłøųŹŌ¼ĮµÄ×ÖÄø)£¬ŹµŃéĻÖĻóĪŖ___________________£¬»Æѧ·“Ó¦·½³ĢŹ½ŹĒ__________________________________£»
A£®Na2SČÜŅŗ B£®Na2SO3ČÜŅŗ C£®Na2SO4ČÜŅŗ
£Ø4£©ŅŃÖŖ£ŗ¢ŁĮņĖį±Č“ĪĀČĖįĪČ¶Ø£»¢ŚøßĀČĖį±ČĮņĖįĖįŠŌĒ棻¢ŪS2-±ČCl-Ņ×±»Ńõ»Æ£»¢ÜHCl±ČH2SĪČ¶Ø£»¢ŻĶÓėŃĪĖį²»·“Ó¦£¬µ«ÄÜÓėÅØĮņĖį·“Ó¦£»¢ŽĢśÓėĀČĘų¼ÓČČÉś³ÉČżĀČ»ÆĢś£¬ĢśÓėĮņ¼ÓČČÉś³ÉĮņ»ÆŃĒĢś”£æÉĖµĆ÷ĀȱČĮņ·Ē½šŹōŠŌĒæµÄŹĒ_________£»
A£®Č«²æ B£®¢Ś¢Ū¢Ü¢Ž C£®¢Ł¢Ś¢Ü¢Ż¢Ž D£®³ż¢ŁŅŌĶā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com